题目内容
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
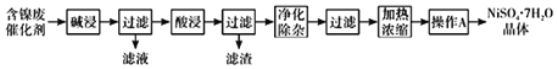
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:
回答下列问题:
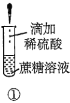
(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
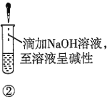
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
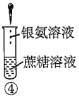
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
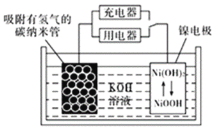
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O H2SO4 将Fe2+氧化为Fe3+ c(OH-)=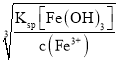 mol/L=10-11.3mol/L,pH=14+lgc(OH-)=2.7 冷却结晶 2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O NiOOH+e-+H2O=Ni(OH)2+OH-
mol/L=10-11.3mol/L,pH=14+lgc(OH-)=2.7 冷却结晶 2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O NiOOH+e-+H2O=Ni(OH)2+OH-
【解析】
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质,目的是用含镍废催化剂制备NiSO47H2O晶体,分析工艺流程,将含Ni废催化剂碱浸,Al和Al2O3溶于碱生成AlO2-,进行过滤,则Fe、Ni及其他不溶于碱的杂质被过滤出,进行酸浸,则Fe和Ni溶于酸形成![]() 和
和![]() ,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Fe2+和Ni2+,净化除杂主要除去Fe元素得到Ni元素的溶液,经过后续处理得到NiSO47H2O。
,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Fe2+和Ni2+,净化除杂主要除去Fe元素得到Ni元素的溶液,经过后续处理得到NiSO47H2O。
(1)“碱浸”时Al和Al2O3溶于碱生成AlO2-,则发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑ , Al2O3+2OH-=2AlO2-+H2O;
(2)工艺流程最终目的是制备NiSO47H2O晶体,所以酸浸时所用的酸应为H2SO4;
(3)加入的H2O2具有氧化性,可将Fe2+氧化为Fe3+,Fe3+更易形成Fe(OH)3而去除Fe元素的;溶液中c(Fe3+)浓度低于10-5mol/L,认为Fe3+几乎完全被除去,此时溶液中c(OH-)=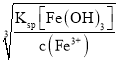 mol/L=
mol/L=![]() =10-11.3mol/L,pH=14+lgc(OH-)=14+lg10-11.3=2.7;
=10-11.3mol/L,pH=14+lgc(OH-)=14+lg10-11.3=2.7;
(4)含有NiSO4的溶液,经过加热浓缩和操作A得到NiSO47H2O晶体,则操作A为冷却结晶;
(5)NiSO4在强碱性溶液中被NaClO氧化为NiOOH,而ClO-被还原为Cl-,反应的离子方程式为:2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O;
(6)NiOOH可作为镍氢电池的电极材料,原电池正极发生还原反应,NiOOH放电转化为Ni(OH)2,溶液呈碱性,则生成OH-,电极反为NiOOH+e-+H2O=Ni(OH)2+OH-。

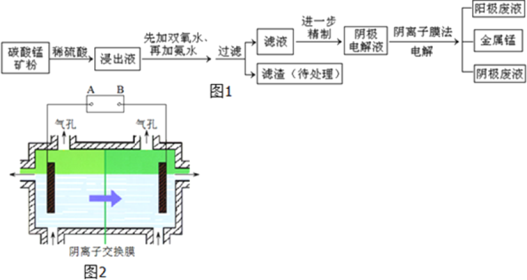
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应