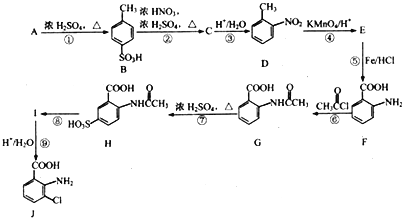
题目内容
【题目】A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。 请回答下列问题:

(1)D的化学式为_______________ 。
(2)反应③的离子方程式为________________________ 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为________________________________ 。
【答案】H2 3NO2+H2O=2H++2NO3-+NO 4NH3+6NO=5N2+6H2O
【解析】
E、F均为气体,且F为红棕色,则F是NO2,E是NO,C是O2。NO2与Z又能生成NO,则Z为H2O,G为HNO3,D为H2。Y与O2能生成NO和水,则Y是NH3,B是N2,A与NH3能产生白烟,则A是Cl2,据此答题。
(1)D的化学式为H2,故答案为:H2。
(2)反应③的离子方程式为:3NO2+H2O=2H++2NO3-+NO,故答案为:3NO2+H2O=2H++2NO3-+NO。
(3)Y是NH3,E是NO,由题意可知NH3与NO反应生成N2和H2O,反应方程式为:4NH3+6NO=5N2+6H2O,故答案为:4NH3+6NO=5N2+6H2O。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1