题目内容
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
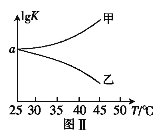
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】2a-b ![]() < 加入催化剂 增大 乙 2 >
< 加入催化剂 增大 乙 2 > ![]() (MPa)-2
(MPa)-2
【解析】
(1)根据盖斯定律将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的;由图Ⅰ虚线知:化学反应速率加快,但平衡不移动,判断改变的条件;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,根据平衡的移动对物质的量的影响,分析判断平均相对分子质量的变化;根据反应③的平衡常数的对数值(lgK)与温度的变化关系图,由于△H3<0,因此升高温度,平衡逆向移动,结合K的变化分析判断正确的曲线;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x,根据三段式计算出25℃时的平衡常数K,再计算lgK,确定a值;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,根据Qc与K的相对大小,判断反应进行的方向,确定v正与v逆的大小;
(3)依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算。
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),该反应△H3=2△H1-△H2=2a-b,则平衡常数K3= ![]() ,故答案为:2a-b;
,故答案为:2a-b;![]() ;
;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随着反应的进行,温度逐渐升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变△H<0;根据图Ⅰ虚线知:化学反应速率加快,但平衡不移动,因此改变的条件为加入催化剂;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生上述反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,平衡正向进行,气体物质的量减小,气体质量不变,则混合气体的平均相对分子质量将增大;反应③2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NO(g)+Cl2(g)2NOCl(g)
起始量(mol/L) 0.08 0.04 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.08-2x0.04-x 2x
(0.08-2x+0.04-x+2x):(0.08+0.04)=5:6,解得:x=0.02mol,平衡常数K3=  =100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=
=100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=![]() =1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂;增大;乙;;>;
=1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂;增大;乙;;>;
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1∶3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.51.5 0.5 0.5
分压=总压×物质的量分数,则P(CO2)=8× ![]() =
= ![]() ,P(H2)=8×
,P(H2)=8×![]() =4,P(CH3OH)=8×
=4,P(CH3OH)=8×![]() =
= ![]() ,P(H2O)=8×
,P(H2O)=8×![]() =
= ![]() ,Kp=
,Kp= ![]() =
=![]() (MPa)-2,故答案为:
(MPa)-2,故答案为:![]() (MPa)-2。
(MPa)-2。