题目内容
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
【答案】B
【解析】
125mL2.6molL-1的硝酸的物质的量为:0.125×2.6=0.325mol,固体恰好完全溶解,所以生成单一的硝酸铜溶液,同时产生一氧化氮气体,由此分析解答。
A. 纯净无色气体Y为NO,与0.75VmL(标准状况)O2混合后通入水中,发生反应4NO + 3O2 + 2H2O =4HNO3,恰好完全反应,气体可被完全吸收,故A正确;B、当V=1680时,即一氧化氮的物质的量为:![]() =0.075mol,原混合粉末中Cu和Cu2O的物质的量分别为xmol和ymol,2x+2y=0.075×3,x+2y=
=0.075mol,原混合粉末中Cu和Cu2O的物质的量分别为xmol和ymol,2x+2y=0.075×3,x+2y=![]() ×(0.325-0.075),解之得:x=0.1,y=0.0125,所以原混合粉末中Cu2O与Cu的物质的量之比为1∶8,故B错误;C. 当全部为Cu2O时,硝酸的物质的量为0.325mol,因此溶液中硝酸铜的物质的量最多为
×(0.325-0.075),解之得:x=0.1,y=0.0125,所以原混合粉末中Cu2O与Cu的物质的量之比为1∶8,故B错误;C. 当全部为Cu2O时,硝酸的物质的量为0.325mol,因此溶液中硝酸铜的物质的量最多为![]() =0.1625mol,固体的质量为0.1625mol×144g/mol=23.4g,当全部为Cu时,硝酸的物质的量为0.325mol,发生3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,只要反应发生均满足题意,即固体质量大于0,因此原混合粉末的总质量不超过23.4g,可能为9.8 g,故C正确;D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,反应后溶液中的溶质为硝酸钠,根据N原子守恒,消耗NaOH的物质的量为(0.325-
=0.1625mol,固体的质量为0.1625mol×144g/mol=23.4g,当全部为Cu时,硝酸的物质的量为0.325mol,发生3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,只要反应发生均满足题意,即固体质量大于0,因此原混合粉末的总质量不超过23.4g,可能为9.8 g,故C正确;D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,反应后溶液中的溶质为硝酸钠,根据N原子守恒,消耗NaOH的物质的量为(0.325-![]() )mol=(0.325-
)mol=(0.325-![]() )mol,故D正确;故选B。
)mol,故D正确;故选B。

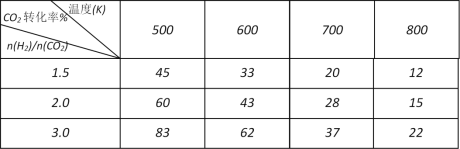
【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) === 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) ===H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
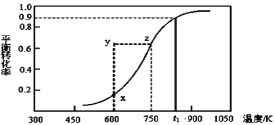
①600K时,Y点甲醇的υ(逆)_____υ(正)(填“>”或“<”)
②若改变条件使之从Y点到X点,则改变条件可以是___________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(I)和(II)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=________;实验温度T1_____T2(填“>”、“<”);催化剂的催化效率:实验①________实验②(填“>”、“<”)。
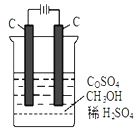
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为____________
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)


(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。