题目内容
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4— +______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因 。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度。他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
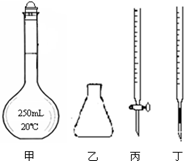
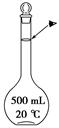
①高锰酸钾溶液应装在 (填下图中的仪器编号)。
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是 。
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是 。
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为 。
(1)4MnO4-+4H+═4MnO2↓+3O2↑+2H2O
(2)2、5、16=2、10、8H2O ;
(3)反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好
(4)①丙
②逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加 (说明:当溶液中生成的Mn2+较多时,反应速率加快后再增大滴加速度)
③0.0200mol/L
解析试题分析:(1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应避光保存配成中性溶液;由题目信息可知,高锰酸钾在酸性条件下会分解生成二氧化锰和氧气,同时会生成水,据此书写离子方程式;
(2)反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O,故答案为:2、5、16=2、10、8H2O ;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以发生碱式滴定管的橡皮管,故应用酸式滴定管盛放;
②逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,防止高锰酸钾在酸性条件下分解;
③令KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
n(C2O42-)=1.34g/134g·mol-1=0.01mol,则:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计
2mol 5mol
c×0.02L×10 0.01mol
所以2mol:5mol=c×0.02L×10:0.01mol
解得c=0.02mol·L-1
故答案为:0.02mol·L-1.
考点:探究物质的组成或测量物质的含量;氧化还原反应;中和滴定.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案实验室制备苯乙酮的化学方程式为: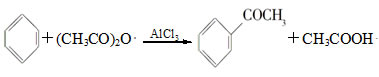
制备过程中还有CH3COOH+AlCl3―→CH3COOAlCl2+HCl↑等副反应。
主要实验装置和步骤如下:
(Ⅰ)合成:在三颈瓶中加入20g无水三氯化铝和30mL
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6mL
乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液
缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层②水层用苯萃取,分液③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品④蒸馏粗产品得到苯乙酮
回答下列问题:(1)仪器a的名称:________;装置b的作用:________。
(2)合成过程中要求无水操作,理由是_______________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |
(5)分液漏斗使用前须________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先________,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下列装置中温度计位置正确的是________,可能会导致收集到的产品中混有低沸点杂质的装置是________。
 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:




 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg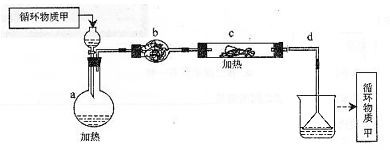
 )如下:
)如下: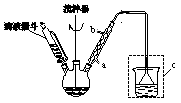
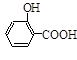 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→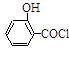 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑  ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。