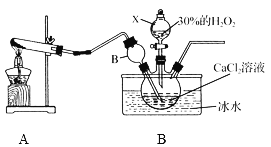
题目内容
【题目】常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=-lgY。下列叙述错误的是
,pY=-lgY。下列叙述错误的是

A.曲线n表示![]() 与pH的变化关系
与pH的变化关系
B.Ka1(H2X)=1.0×10-10.3
C.NaHX溶液中c(OH-)>c(H+)
D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
【答案】B
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),则pH相同时 <
<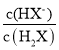 ,pY=-lgY,则p
,pY=-lgY,则p >p
>p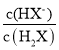 ,则m、n分别表示pH与p
,则m、n分别表示pH与p 、p
、p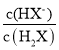 的变化关系,据此结合选项分析解答。
的变化关系,据此结合选项分析解答。
A.根据分析可知,n表示pH与p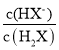 的变化关系,A选项正确;
的变化关系,A选项正确;
B.M点pH=9.3,c(H+)=10-9.3mol/L,p =-lg
=-lg =1,则
=1,则 =0.1,所以Ka2(H2X)=
=0.1,所以Ka2(H2X)= ×c(H+)=10-9.3×0.1=1.0×10-10.3,N点pH=7.4,c(H+)=10-7.4mol/L,p
×c(H+)=10-9.3×0.1=1.0×10-10.3,N点pH=7.4,c(H+)=10-7.4mol/L,p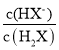 =-lg
=-lg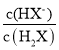 =-1,则
=-1,则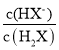 =10,所以Ka1(H2X)=
=10,所以Ka1(H2X)=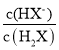 ×c(H+)=10-7.4×10=1.0×10-6.4,B选项错误;
×c(H+)=10-7.4×10=1.0×10-6.4,B选项错误;
C.根据B可知HX﹣的电离平衡常数为1.0×10﹣10.3;曲线n表示pH与p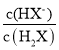 的变化关系,n点pH=7.4,p
的变化关系,n点pH=7.4,p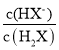 =-lg
=-lg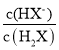 =-1,
=-1,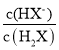 =10,所以HX-的水解平衡常数Kh=
=10,所以HX-的水解平衡常数Kh=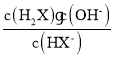 =
=![]() =1.0×10-7.6>1.0×10-10.3,说明HX-的水解程度大于其电离程度,则NaHX溶液溶液呈碱性,c(H+)<c(OH-),C选项正确;
=1.0×10-7.6>1.0×10-10.3,说明HX-的水解程度大于其电离程度,则NaHX溶液溶液呈碱性,c(H+)<c(OH-),C选项正确;
D.当溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HX-)+2c(X2-)+c(Cl-),D选项正确;
答案选B。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目