题目内容
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
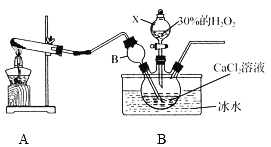
①装置A中发生反应的化学方程式为____________。
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.__________________________________。
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:______。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为____(用含字母的代数式表示)。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 温度高时,H2O2会分解 取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净
CaCl2+2NH3↑+2H2O 温度高时,H2O2会分解 取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净 ![]() 或
或 ![]()
【解析】
(1)①根据题意,反应有氨气参与,A装置为Ca(OH)2与NH4Cl共热制氨气,据此书写;
②考虑过氧化氢受热易分解;
③根据反应CaO28H2O晶体表面附着NH4Cl,检验洗涤液是否含有氯离子可检验晶体是否洗净,据此分析作答;
(2)根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,根据关系式列方程计算。
(1)①根据题意,反应有氨气参与,A装置为Ca(OH)2与NH4Cl共热制氨气,反应为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②装置C采用冰水浴控制温度在0℃左右,因为该反应是放热反应,温度低有利于提高CaO28H2O产率,同时防止温度高时H2O2会分解;
③CaO28H2O晶体表面附着NH4Cl,检验洗涤液是否含有氯离子可检验晶体是否洗净,故检验晶体已洗涤干净的操作为;取最后一次洗涤后的滤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液(或硝酸酸化的硝酸银溶液),若无白色沉淀生成,则说明已经洗涤干净;
(2)根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,则由CaO2~I2~2S2O32-可知:参加反应的CaO2的物质的量为V×10-3L×cmolL-1×![]() =5Vc×10-4mol,产品中CaO2·8H2O的质量分数为
=5Vc×10-4mol,产品中CaO2·8H2O的质量分数为![]() =
=![]() 。
。