题目内容
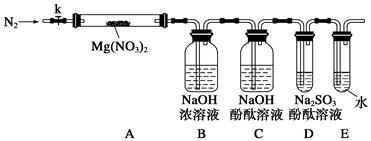
(11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)

(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3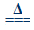 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3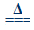 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是 ,并说明理由: 。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律: 。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)

(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3
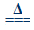 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3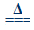 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。Ⅰ、Ⅱ中正确的是 ,并说明理由: 。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律: 。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
(1)Ca(NO3)2受热分解的产物:Ca(NO2)2、O2
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2△2CuO+4NO2↑+O2↑
(3) Ⅱ正确;气泡仅部分消失,且剩余氧气等;取少量分解后固体,加入硝酸或氨水;
(4)硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。 (5)85b/28a%
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2△2CuO+4NO2↑+O2↑
(3) Ⅱ正确;气泡仅部分消失,且剩余氧气等;取少量分解后固体,加入硝酸或氨水;
(4)硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。 (5)85b/28a%
试题分析:(1)根据题意可得Ca(NO3)2分解的化学方程式:Ca(NO3)2△ Ca(NO3)2+O2 ↑,所以分解产物是Ca(NO3)2和O2;(2)根据题意可得Cu(NO3)2分解的化学方程式:2Cu(NO3)2△2CuO+4NO2↑+O2↑;(3)若是发生Ⅰ反应,由于4NO2+O2+2H2O=4HNO3,液体不会被压至装置③中。若是发生Ⅱ反应,由于产生的NO2和O2的体积比为2:1,所以氧气过量,因此还有不能转换的气体剩余,装置②中气泡部分消失,剩余的气体也能使带火星的木条复燃。溶液也变为红色,现象吻合。因此Ⅱ正确。证明结论的实验是取少量分解后固体,加入硝酸或氨水;观察现象进行分析得到结论。(4)硝酸盐受热分解的规律:硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。特别活泼的金属的硝酸盐负极得到亚硝酸盐和氧气;比较活泼的金属的硝酸盐分解得到金属氧化物、二氧化氮和氧气,比活泼的金属的硝酸盐分解得到金属单质、二氧化氮和氧气。(5)2AgNO3 △2Ag+2NO2↑+O2↑,2NO2+1/2O2+H2O=2HNO3,反应中的物质的量的关系是2AgNO3~2NO2~1/2O2。若分解2×170g AgNO3,会有1/2×11200ml的水进入量筒,现在有bml的水,所以分解的AgNO3质量是m=2×170b÷11200g.而加入的AgNO3质量是ag,所以硝酸银的分解率是(m÷a)×100%=(2×170b÷11200g)÷a×100%=85b/28a%

练习册系列答案
相关题目