题目内容
古有“杜康酿酒反为醋”的传说,高粱、玉米等粮食是酿酒工业的主要原料。粮食发酵可得有机化合物A,在A分子中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧元素。又知A在一定条件下可生成B,在加热和浓硫酸作用下,A与B反应可生成一种有香味的物质C,若184gA和120gB反应能生成106gC,计算该反应的产率(写出计算过程)。
60.2%。
A分子中碳的质量分数为52.2%,氢的质量分数为13.0%,所以氧的质量分数为1-13.0%-52.2%=34.8%,故碳、氢、氧的原子个数比为52.2%÷12:13.0%÷1:34.8%÷16≈2:6:1,即A的最简式为C2H6O,由碳、氢原子个数比知该物质已达饱和,故A的分子式为C2H6O,其相对分子质量为46(2分);根据题意可得A为C2H5OH ,C为CH3COOH,二者反应的化学方程式为:CH3COOH + C2H5OH 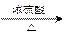 CH3COOH + H2O (2分)已知n(CH3COOH)===2mol,n(C2H5OH)==> 2mol
CH3COOH + H2O (2分)已知n(CH3COOH)===2mol,n(C2H5OH)==> 2mol
所以乙醇过量,应以乙酸计算产率,2mol乙酸完全酯化可生成乙酸乙酯2mol×88g·mol-1=176g,所以该反应的产率为×100%=60.2%(2分)
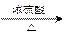 CH3COOH + H2O (2分)已知n(CH3COOH)===2mol,n(C2H5OH)==> 2mol
CH3COOH + H2O (2分)已知n(CH3COOH)===2mol,n(C2H5OH)==> 2mol所以乙醇过量,应以乙酸计算产率,2mol乙酸完全酯化可生成乙酸乙酯2mol×88g·mol-1=176g,所以该反应的产率为×100%=60.2%(2分)

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目

 CaSiO3+CO2↑
CaSiO3+CO2↑

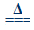 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3