题目内容
8.硅是信息产业、太阳能电池光电转化的基础材料.锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如图:
(1)焦炭在过程Ⅰ中作还原剂.
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是2NaCl+2H2O通电$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(3)整个制备过程必须严格控制无水.
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是SiCl4+2H2O═SiO2+4HCl.
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中.冷却的作用是使水蒸气冷凝,减少进入浓硫酸的水量,保持持续的吸水性,并降低放出的热量.
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃,SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(l)△H1<0
反应2:756℃~907℃,SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(g)△H2<0
反应3:907℃~1410℃,SiCl4(g)+2Zn(g)?Si(s)+2ZnCl2(g)△H3<0
①对于上述三个反应,下列说法合理的是b c d.
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
②实际制备过程选择“反应3”,选择的理由是温度高,反应速率快;与前两个反应比较,更易于使硅分离,使化学平衡向右移动,提高转化率.
③已知Zn(l)═Zn(g)△H=+116KJ/mol.若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出208.8kJ的热量.
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层.腐蚀剂常用稀HNO3和HF的混合液.硅表面首先形成SiO2,最后转化为H2SiF6.用化学方程式表示SiO2转化为H2SiF6的过程SiO2+6HF═H2SiF6+2H2O.
分析 (1)依据碳与二氧化硅反应中元素化合价变化解答;
(2)工业上用电解饱和食盐水制备氯气;
(3)①四氯化硅与水反应生成二氧化硅和氯化氢;
②使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(4)①△H<0表示放热,根据平衡移动的原理解答;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,温度高,反应速率更快;
③根据盖斯定律可以计算化学反应的焓变;
(5)氟化氢跟二氧化硅反应生成四氟化硅和水,四氟化硅和氟化氢直接反应生成H2SiF6.
解答 解:(1)在SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,碳元素化合价升高,被氧化,做还原剂,故答案为:还原剂;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,方程式:2NaCl+2H2O 通电$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
故答案为:2NaCl+2H2O 通电$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)①四氯化硅与水反应生成二氧化硅和氯化氢,化学方程式:SiCl4+2H2O═SiO2+4HCl;
故答案为:SiCl4+2H2O═SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(4)①通过热化学方程式可知,对于三个反应的反应热都是△H<0表示,都是放热反应,
a.升高温度,平衡向吸热的方向移动,所以会降低SiCl4的转化率,故a错误;
b.Si遇氧气在高温的条件下反应生成二氧化硅,所以还原过程需在无氧的气氛中进行,b正确;
c.有气体参加的反应,增大压强,能加快反应的速率,对于三个反应,都有气体参与,所以增大压强,能提高反应的速率,故c正确;
d.Na、Mg都是还原性比较强的金属,可以代替Zn还原SiCl4,故d正确;
故选:b c d;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,反应物都为气态,温度高,反应速率更快,所以实际制备过程选择“反应3”,温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率,
故答案为:温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率;
③每投入1mol SiCl4,有2molZn参加反应,“反应3”与“反应2”比较,反应2中锌为液态,根据Zn(l)═Zn(g)△H=+116KJ/mol,若SiCl4的转化率均为90%,“反应3”比“反应2”多放出116KJ/mol×2×90%=208.8KJ,
故答案为:208.8;
(5)二氧化硅和氢氟酸:SiO2+4HF=SiF4↑+2H2O;SiF4+2HF=H2SiF6,所以用稀HNO3和HF的混合液,硅表面首先形成SiO2,最后转化为H2SiF6的化学方程式为SiO2+6HF═H2SiF6+2H2O,
故答案为:SiO2+6HF═H2SiF6+2H2O.
点评 本题考查了硅及其化合物的性质及化学平衡相关知识,掌握平衡移动原理的运用,掌握硅及其化合物的性质是解答的关键,难度中等.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
| A. | 用装置甲验证在该条件下铁钉发生吸氧腐蚀 | |
| B. | 装置乙用于HCl的吸收,以防倒吸 | |
| C. | 用装置丙验证实验室制得的乙烯中混有二氧化硫和二氧化碳 | |
| D. | 关闭活塞a,从b处加水,以检查装置丁的气密性 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:离子键.
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)设计实验证明:元素①比元素⑤的非金属性强:向盛有少量Na2SiO3溶液的试管里通入CO2气体,有白色胶状沉淀产生.
| A. | 如图所示正反应的活化能为E-E 1 | |
| B. | 活化分子具有比普通分子更高的能量 | |
| C. | 反应物的分子的每次碰撞都能发生化学反应 | |
| D. | 反应物分子间的有效碰撞是发生化学反应的充要条件 |
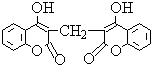 某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )| A. | 有望将它发展制得一种抗凝血药 | |
| B. | 它无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药 | |
| C. | 它可由化合物和甲醛(HCHO)通过缩合反应制得 | |
| D. | 它与足量NaOH溶液反应,消耗NaOH 6mol |
| A. | 乙烯分子中碳碳双键的键长等于乙烷分子中碳碳单键的键长 | |
| B. | 乙烯分子中的碳、氢原子都处在同一平面上,而乙烷分子中的碳、氢原子不都处在同一平面上 | |
| C. | 乙烯和乙烷分子中碳氢键的键角都是120° | |
| D. | 乙烯分子中碳碳双键的键能大于乙烷分子中碳碳单键的键能 |
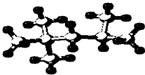 按要求完成下列问题:
按要求完成下列问题: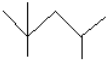 ;
; 或
或 .
.