题目内容
19.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子;元素B的氢化物能用于刻蚀玻璃;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)E的核外电子排布式是1s22s22p63s23p63d104s1(或[Ar]3d104s1),A、B、C、D的第一电离能由小到大的顺序为Al<S<N<F.
(2)化合物CA的熔点远高于C的氯化物的熔点,理由是AlN为原子晶体而AlCl3为分子晶体;
(3)A的最高价含氧酸根离子中,其中心原子采取sp2杂化,D的低价氧化物分子的空间构型是V形.
(4)B2与NaOH溶液反应的产物之一是OB2,该反应的离子方程式为2F2+2OH-=OF2+2F-+H2O.
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,A原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,元素B的氢化物能用于刻蚀玻璃,则B为F元素,C元素是地壳中含量最高的金属元素,则C为Al元素,D原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,应为S元素,E原子核外最外层只有1个电子,其余各层电子均充满,原子序数大于硫,则E的电子排布式为1S22S22P63S23P63d104S1,所以E为Cu元素,据此答题;
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,A原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,元素B的氢化物能用于刻蚀玻璃,则B为F元素,C元素是地壳中含量最高的金属元素,则C为Al元素,D原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,应为S元素,E原子核外最外层只有1个电子,其余各层电子均充满,原子序数大于硫,则E的电子排布式为1S22S22P63S23P63d104S1,所以E为Cu元素,
(1)根据上面的分析可知,E为Cu元素,E的核外电子排布式是1s22s22p63s23p63d104s1(或[Ar]3d104s1),在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Al<S<N<F,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);Al<S<N<F;
(2)化合物CA为AlN,C的氯化物为AlCl3,AlN为原子晶体而AlCl3为分子晶体,所以AlN的熔点远高于AlCl3的熔点,
故答案为:AlN为原子晶体而AlCl3为分子晶体;
(3)A的最高价含氧酸根离子为NO3-,NO3-中氮原子的价层电子对数为$\frac{5+1}{2}$=3,所以氮原子采取sp2杂化,D的低价氧化物为SO2,由于分子中硫原子的价层电子对数为$\frac{6}{2}$=3,分子中有一对孤电子对,所以分子的空间构型是V形,
故答案为:sp2;V形;
(4)F2与NaOH溶液反应的产物之一是OF2,该反应的离子方程式为2F2+2OH-=OF2+2F-+H2O,
故答案为:2F2+2OH-=OF2+2F-+H2O.
点评 本题考查元素推断题,推断出元素的种类是解答本题的关键,推断时注意从原子的核外电子排布特点以及元素的特殊性质为突破口解答,本题具有一定难度.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 石油、液氧 | B. | 碘酒、干冰 | ||
| C. | Na2CO3•10H2O、石墨 | D. | 盐酸、水 |
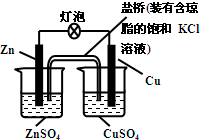
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-═Zn2+ | |
| C. | 在外电路中,电流从负极流向正极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
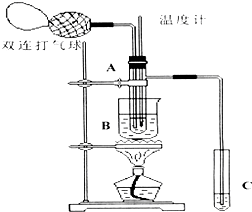 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀.(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(3)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是发生氧化反应,溶液的酸性均增强.
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
 如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )| a极板 | b极板 | Y电极 | c溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 石墨 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | HA为强酸 | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | pH=7时,c(Na+)=c(A-)+c(HA) |
