题目内容
12.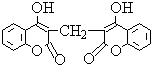 某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )| A. | 有望将它发展制得一种抗凝血药 | |
| B. | 它无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药 | |
| C. | 它可由化合物和甲醛(HCHO)通过缩合反应制得 | |
| D. | 它与足量NaOH溶液反应,消耗NaOH 6mol |
分析 由双香豆素的结构可知,分子中含-COOC-、-OH、碳碳双键,结合酯、醇、烯烃的性质来解答.
解答 解:A.由信息可知,小母牛食用腐败草料后,血液不会凝固,则有望将它发展制得一种抗凝血药,故A正确;
B.含苯环,为芳香族化合物,无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药,故B正确;
C.由结构可知,该物质可由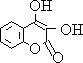 和甲醛(HCHO)通过缩合反应制得,故C正确;
和甲醛(HCHO)通过缩合反应制得,故C正确;
D.只有-COOC-及水解生成的酚-OH与NaOH反应,则1mol它与足量NaOH溶液反应,消耗NaOH 4mol,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团与性质的关系为解答的关键,侧重分析及应用能力的考查,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
5.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.
(1)O2-的电子式为 ;
;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(任写两种)(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中
c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
(1)O2-的电子式为
 ;
;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(任写两种)(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中
c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
5.煤化工中两个重要反应为①C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如表三组数据:
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为0.04mol/(L•min).
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
1.下列化学反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
19.下列说法中,正确的是( )
| A. | 1mol O2和1mol N2所占的体积都约为22.4L | |
| B. | 在标准状况下,H2的气体摩尔体积为22.4L | |
| C. | 在标准状况下,1mol H2和1mol H2O所占的体积都约22.4L | |
| D. | 在标准状况下,22.4L由N2,N2O组成的混合气体中所含有的氮原子的物质的量约为2mol |
 已知氮化铝的晶胞结构如图所示.请回答下列问题:
已知氮化铝的晶胞结构如图所示.请回答下列问题:
 已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;
已知:①A 是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;