题目内容
已知: ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化:
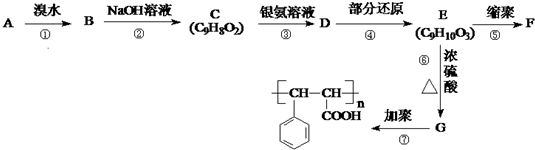
(1)反应类型:② ,③ .
(2)结构简式 A ,G .
(3)反应的化学方程式:① ;⑤ .
(4)上述流程中的物质,互为同分异构体的是 (选填编号).
(5)写出由A转化为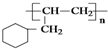 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.) .
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.) .
 ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化:
(1)反应类型:②
(2)结构简式 A
(3)反应的化学方程式:①
(4)上述流程中的物质,互为同分异构体的是
(5)写出由A转化为
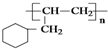 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)考点:有机物的推断
专题:有机物的化学性质及推断
分析:由G的加聚产物结构可知G为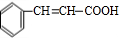 ,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为
,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为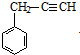 ,顺推可知B为
,顺推可知B为 ,C为
,C为 ,D为
,D为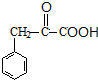 ,E为
,E为 ,E发生缩聚反应生成F为
,E发生缩聚反应生成F为 ,据此解答.
,据此解答.
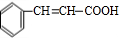 ,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为
,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为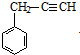 ,顺推可知B为
,顺推可知B为 ,C为
,C为 ,D为
,D为 ,E为
,E为 ,E发生缩聚反应生成F为
,E发生缩聚反应生成F为 ,据此解答.
,据此解答.解答:
解:由G的加聚产物结构可知G为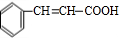 ,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为
,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为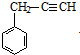 ,顺推可知B为
,顺推可知B为 ,C为
,C为 ,D为
,D为 ,E为
,E为 ,E发生缩聚反应生成F为
,E发生缩聚反应生成F为 ,
,
(1)反应②是 发生取代反应生成
发生取代反应生成 ;
;
反应③是 发生氧化反应生成
发生氧化反应生成 ,
,
故答案为:取代反应;氧化反应;
(2)由上述分析可知,A为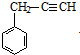 ,G为
,G为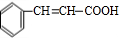 ,
,
故答案为: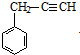 ;
;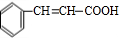 ;
;
(3)反应①的化学方程式为: ;
;
反应⑤的化学方程式为: ,
,
故答案为: ;
; ;
;
(4)上述流程中的物质,C与G的分子式相同,结构不同,互为同分异构体,
故答案为:CG;
(5)由A转化为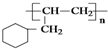 的线路为:
的线路为: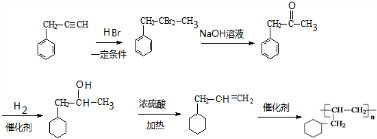
故答案为: .
.
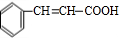 ,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为
,E在浓硫酸、加热条件下得到G,结合E的分子式可知,应是E分子内脱去1分子水生成G,A与溴水发生反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C可以发生银镜反应生成D,D部分还原生成E,故B中侧链端碳原子应连接2个Br原子,结合G的结构可知A为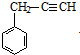 ,顺推可知B为
,顺推可知B为 ,C为
,C为 ,D为
,D为 ,E为
,E为 ,E发生缩聚反应生成F为
,E发生缩聚反应生成F为 ,
,(1)反应②是
 发生取代反应生成
发生取代反应生成 ;
;反应③是
 发生氧化反应生成
发生氧化反应生成 ,
,故答案为:取代反应;氧化反应;
(2)由上述分析可知,A为
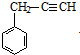 ,G为
,G为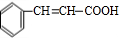 ,
,故答案为:
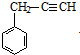 ;
;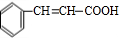 ;
;(3)反应①的化学方程式为:
 ;
;反应⑤的化学方程式为:
 ,
,故答案为:
 ;
; ;
;(4)上述流程中的物质,C与G的分子式相同,结构不同,互为同分异构体,
故答案为:CG;
(5)由A转化为
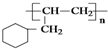 的线路为:
的线路为:
故答案为:
 .
.
点评:本题考查有机物推断,根据G的加聚产物确定G的结构,结合反应信息及反应条件,采取正推法、逆推法相结合进行解答,较好的考查学生逻辑推理能力,确定B的结构特点是关键,注意2个羟基连接同一碳原子上会脱去1分子水形成碳氧水解,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液一定可以大量存在K+、Na+、AlO2-、SO42- | ||
B、常温时,0.1mol/L HA溶液的PH>1,0.1mol/LBOH溶液中
| ||
| C、用0.10mol?L-1 NaOH溶液滴定某浓度的醋酸溶液时,指示剂选酚酞比选用甲基橙误差小 | ||
| D、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均减小 |
下列离子方程式正确的是( )
| A、在硫酸亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)
| ||||
| C、过量的KHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||
| D、向稀氢氧化钠溶液中通入少量CO2:OH-+CO2═HCO3- |
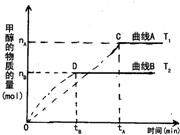 在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:
在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:

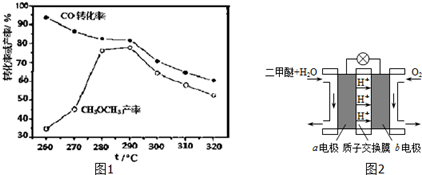


 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: