题目内容
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.
镓(31Ga)的基态电子排布式是 ;
31Ga的第一电离能却明显低于30Zn,原因是 ;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物.
(1)CO和NH3可以和很多过渡金属形成配合物.CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 .NH3分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 .
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体.蓝色沉淀先溶解,后析出的原因是: (用相关的离子方程式和简单的文字说明加以解释).
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是 .

(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示).
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.
镓(31Ga)的基态电子排布式是
31Ga的第一电离能却明显低于30Zn,原因是
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物.
(1)CO和NH3可以和很多过渡金属形成配合物.CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体.蓝色沉淀先溶解,后析出的原因是:
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是

(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为
考点:原子核外电子排布,判断简单分子或离子的构型,晶胞的计算
专题:原子组成与结构专题,化学键与晶体结构
分析:Ⅰ.镓是31号元素,该原子核外有31个电子,根据能量最低原理书写核外电子排布式;
Zn原子的4s轨道为全充满状态,较稳定,第一电离能较高;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
NH3分子中N原子成3个N-H键、含有1对孤电子对,据此确定N原子杂化方式及空间结构;
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成氢氧化铜沉淀,继续加氨水,氢氧化铜溶解得到四氨合铜络离子,溶液呈深蓝色透明溶液,若加入极性较小的溶剂乙醇,生成的[Cu(NH3)4]SO4析出得到深蓝色的晶体;
(3)由图中直接相邻的原子数可以求出a、b中两类原子数目之比,据此确定;
(4)根据均摊法计算晶胞中Cu原子数目,结合相对分子质量及阿伏伽德罗常数表示出晶胞质量,根据晶胞棱长计算晶胞体积,再根据密度计算晶胞质量,据此列方程计算.
Zn原子的4s轨道为全充满状态,较稳定,第一电离能较高;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
NH3分子中N原子成3个N-H键、含有1对孤电子对,据此确定N原子杂化方式及空间结构;
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成氢氧化铜沉淀,继续加氨水,氢氧化铜溶解得到四氨合铜络离子,溶液呈深蓝色透明溶液,若加入极性较小的溶剂乙醇,生成的[Cu(NH3)4]SO4析出得到深蓝色的晶体;
(3)由图中直接相邻的原子数可以求出a、b中两类原子数目之比,据此确定;
(4)根据均摊法计算晶胞中Cu原子数目,结合相对分子质量及阿伏伽德罗常数表示出晶胞质量,根据晶胞棱长计算晶胞体积,再根据密度计算晶胞质量,据此列方程计算.
解答:
解:Ⅰ.镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以其核外电子排布式为1s22s22p63s23p63d104s24p1;
Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,体系的能量较低,较稳定,故Zn的第一电离能大于Ga;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为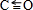 ;
;
NH3分子中N原子成3个N-H键、含有1对孤电子对,N原子杂化方式为sp3,空间结构为三角锥形,
故答案为: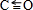 ;sp3;三角锥形;
;sp3;三角锥形;
(2)氢氧化铜与氨水发生反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,沉淀溶解,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体,
故答案为:氢氧化铜与氨水发生反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体;
(3)a图中每个斜线球周围有6个白色球,而每个白色球为3个斜线球共有,故斜线球与白色球数目之比=
1:6×
=1:2,
b图中每个斜线球周围有6个白色球,而每个白色球为2个斜线球共有,故斜线球与白色球数目之比=1:6×
=1:3,
故图b符合化学式为AX3,
故答案为:b;
(4)晶胞中含有铜原子数目=8×
+6×
=4,则晶胞质量为
g,该晶胞体积为a3 cm3,则
g=a3 cm3×ρ g/cm3,故NA=
,
故答案为:
.
Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,体系的能量较低,较稳定,故Zn的第一电离能大于Ga;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为
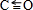 ;
;NH3分子中N原子成3个N-H键、含有1对孤电子对,N原子杂化方式为sp3,空间结构为三角锥形,
故答案为:
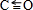 ;sp3;三角锥形;
;sp3;三角锥形;(2)氢氧化铜与氨水发生反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,沉淀溶解,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体,
故答案为:氢氧化铜与氨水发生反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体;
(3)a图中每个斜线球周围有6个白色球,而每个白色球为3个斜线球共有,故斜线球与白色球数目之比=
1:6×
| 1 |
| 3 |
b图中每个斜线球周围有6个白色球,而每个白色球为2个斜线球共有,故斜线球与白色球数目之比=1:6×
| 1 |
| 2 |
故图b符合化学式为AX3,
故答案为:b;
(4)晶胞中含有铜原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×64 |
| NA |
| 4×64 |
| NA |
| 256 |
| ρa3 |
故答案为:
| 256 |
| ρa3 |
点评:本题是对物质结构的考查,涉及核外电子排布式、电离能、分子结构、杂化轨道、配合物、晶胞计算等,难度中等,注意利用均摊法进行晶胞有关计算,理解同周期第一电离能突跃原因.

练习册系列答案
相关题目
下列装置属于原电池的是( )
A、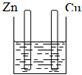 稀硫酸 |
B、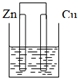 酒精 |
C、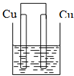 稀硫酸 |
D、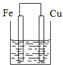 稀硫酸 |
在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中NH4+的物质的量浓度分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、a=c>b |
| C、b>a>c |
| D、c>a>b |
 化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.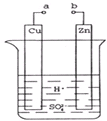 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.  ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化: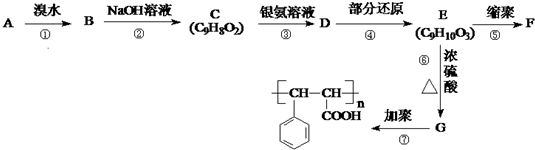
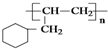 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)