题目内容
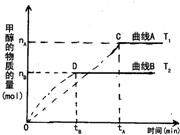 在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:
在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).反应达到平衡时,平衡常数表达式K=
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:依据化学反应平衡常数概念结合化学方程式书写表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,平衡常数随温度变化,图象分析先拐先平,温度高,结合甲醇物质的量变化判断反应是放热反应,升温平衡逆向进行,平衡常数减小;依据图象分析甲醇物质的量变化得到浓度变化,依据速率概念计算V(CH3OH),结合反应速率之比等于化学方程式计量数之比得到氢气的反应速率.
解答:
解:CO(g)+2H2(g)?CH3OH(g),反应达到平衡时,平衡常数表达式K=
;图象分析可知先拐先平温度高,T2>T1,温度越高甲醇物质的量越小,说明升温平衡逆向进行,逆向是吸热反应,正反应是放热反应,升温平衡逆向进行,平衡常数减小;
在图象中,T2时,从反应开始到平衡甲醇生成物质的量nB,V(H2)=2V(CH3OH)=2×
=
mol/L?min;
故答案为:
;减小;
mol/L?min.
| c(CH3OH) |
| c(CO)c2(H2) |
在图象中,T2时,从反应开始到平衡甲醇生成物质的量nB,V(H2)=2V(CH3OH)=2×
| ||
| tBmin |
| 2nB |
| 3tB |
故答案为:
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
点评:本题考查了化学平衡常数、化学反应速率概念的理解应用,图象分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
以下比较中,正确的是( )
| A、微粒半径:F->O2->Na+>Li+ |
| B、电负性Cl>C,酸性:HClO4>H2CO3 |
| C、分子中的键角:CH4>H2O>CO2 |
| D、稳定性:LiCl<NaCl<KCl<RbCl |
下列说法中,正确地是( )
| A、一个氮原子的质量就是氮的相对原子质量 |
| B、一个碳原子的质量约为1.99×10-23g |
| C、氧气的摩尔质量在数值上等于它们的相对分子质量 |
| D、氢氧化钠的摩尔质量是40g |
在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中NH4+的物质的量浓度分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、a=c>b |
| C、b>a>c |
| D、c>a>b |
下列有关元素的性质及其递变规律正确的是( )
| A、IA族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B、第二周期元素从左到右,最高正价从+1递增到+7,最低负价从-4升高到-1 |
| C、同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D、同周期主族金属元素的化合价越高,其原子失电子能力越强 |
 化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能. ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化: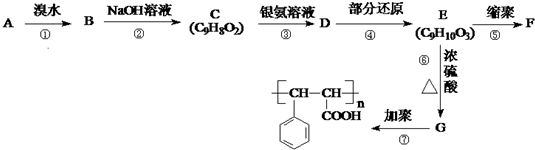
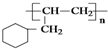 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)