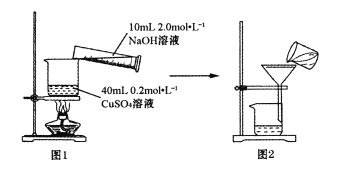
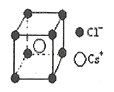题目内容
【题目】下列实验方案不能达到预期目的的是
实验方案 | 实验目的 | |
A | 向两支试管中分别加入 | 探究 |
B | 取 | 配制8%的 |
C | 将 | 比较 |
D | 测同温同浓度 | 比较硫和硅两元素非金属性强弱 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向两支试管中分别加入2mL5%H2O2溶液,然后只向其中一支试管中加入绿豆大小的FeI2固体,FeI2与H2O2会发生氧化还原反应,且生成的Fe3+也可以催化H2O2的分解,故不能用来探究I-对H2O2分解反应的催化作用, A 错误。
B.取8gNaOH固体加入到92mL水中(的密度近似看作1g/mL),所得溶液的质量百分含量为:![]() ,故B正确;
,故B正确;
C.将ZnSO4溶液滴入盛有2mLNa2S溶液的试管中至不再产生沉淀,然后滴入相同浓度的CuSO4溶液,可以观察到沉淀由白色转化为黑色,且ZnS(白色)和CuS(黑色)相同类型的物质,故可以据此来比较溶度积常数属性强弱,C正确;
D.测同温同浓度Na2SO4和Na2SiO3水溶液的PH,Na2SO4溶液呈中性,说明Na2SO4是强酸强碱盐,而Na2SiO3溶液呈碱性,说明Na2SiO3为强碱弱酸盐,即H2SO4为强酸,H2SiO3为弱酸,故比较硫和硅两元素非金属性强弱,D正确;
故答案为:A。

【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为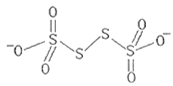 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
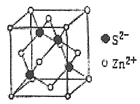
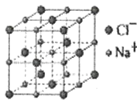
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。