题目内容
常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L |
| C.等物质的量浓度等体积的HX与CH3COONa两溶液混合后所得溶液中: c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向等浓度等体积的HX和CH3COOH溶液中,分别加入同浓度的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者 |
B
解析试题分析:B、由题干信息0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9可知前者是强酸,后者是弱酸,将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L,由于后者不能完全电离所以c(H+)小于0.2 mol/L
考点:考查弱电解质的电离平衡和溶液中离子浓度的大小判断。

练习册系列答案
相关题目
下列说法正确的是
| A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+) + c(CH3COOH) =" 2" c(OH-) + c(CH3COO-) |
| D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
水是最宝贵的资源之一。 下列表述正确的是
A.H2O的电子式为 |
| B.273K、101kPa,水的分子间距离:d(气态)>d(液态)>d(固态) |
| C.4℃时,纯水的pH=7 |
| D.D216O中,质量数之和是质子数之和的两倍 |
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O 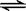 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2 |
| D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
下列有关溶液中微粒浓度关系的叙述正确的是
| A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.向CH3COONa溶液中滴加稀HCl至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH) |
| D.等物质的量浓度CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-) |
关于常温下pH = 12的NaOH溶液,下列说法错误的是
| A.c(OH-) =c(Na+) + c(H+) |
| B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.与等体积pH = 2的醋酸混合后所得溶液显碱性 |
| D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)> c(NH4+) |
25℃时,下列说法正确的是
A.pH =8.3的NaHCO3溶液:c( Na+)>c( HC )>c(C )>c(C  )>c( H2CO3) )>c( H2CO3) |
| B.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| C.用一定浓度的NaOH溶液滴定氢氟酸,当pH =6时,溶液中c(F—)—c(Na+)=9.9×l0—7 mol/L |
| D.用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |