题目内容
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
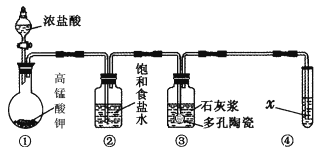
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O 5∶1 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 将装置③放于冷水浴中进行实验 42.90% 偏低
Mn2++Cl2↑+2H2O 2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O 5∶1 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 将装置③放于冷水浴中进行实验 42.90% 偏低
【解析】本题主要考查关于物质的量的计算。
Ⅰ.(1)二氧化锰与浓盐酸反应制氯气的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)高锰酸钾与浓盐酸反应制氯气的化学方程式:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
(3)氯酸钾与浓盐酸反应制氯气,从该反应的化学方程式:KClO3+6HCl(浓)![]() KCl+3Cl2↑+3H2O可以看出,氯气的5/6来自于HCl,1/6来自于KClO3,所以该反应中氧化产物与还原产物的物质的量之比为5:1。
KCl+3Cl2↑+3H2O可以看出,氯气的5/6来自于HCl,1/6来自于KClO3,所以该反应中氧化产物与还原产物的物质的量之比为5:1。
Ⅱ.(1)装置③中氯气与氢氧化钙发生反应,该反应的化学方程式为2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是将装置③放于冷水浴中进行实验。
(2)消耗KI溶液体积的平均值为20.00mL,6ClO-~2I-~3Ca(ClO)2,该漂白粉中有效成分Ca(ClO)2的质量分数为1.5×0.1000mol·L-1×0.02000L×143g/mol_/1.000g=42.90%;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,由于所用KI溶液减少,所以测定结果将偏低。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案