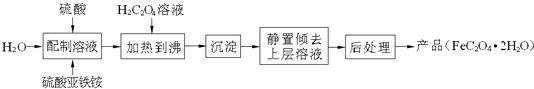
题目内容
【题目】利用下图装置探究温度对氨气还原Fe2O3的影响(固定装置略).
完成下列填空:
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
乙组得到的黑色粉末是;步骤1甲组中反应的离子方程式为;
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为 .
【答案】
(1)吸收混合气体中的HI
(2)Zn+I2═ZnI2
(3)Fe;Fe3O4+8H+=2Fe3++Fe2++4H2O
(4)2:1
【解析】解:(1)混合气体的碘化氢会干扰实验,则C装置中的碱石灰作用是吸收混合气体中的碘化氢,所以答案是:吸收混合气体中的HI;(2)装置B的作用是吸收碘蒸气,锌与碘单质反应生成碘化锌,反应的化学方程式为:Zn+I2═ZnI2 , 所以答案是:Zn+I2═ZnI2;(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;根据甲组现象可知,Fe2O3与氨气在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4 , 四氧化三铁与盐酸反应生成氯化铁和氯化亚铁,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,所以答案是:Fe;Fe3O4+8H+=2Fe3++Fe2++4H2O;(4)设氧化铁的物质的量为x,氧化亚铁的物质的量为y,则:160x+72y=7.84、(2x+y)×56=5.6,联立解得:x=0.04mol、y=0.02mol,则混合物中Fe2O3和FeO的物质的量之比为:0.04mol:0.02mol=2:1,所以答案是:2:1.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
Q | R | ||
T | W |
(1)R的原子结构示意图是 , 用化学方程式表示工业上常用于冶炼T单质的原理是 .
(2)元素的非金属性:QW(填“强于”或“弱于”),简述其原因是 .
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式 .