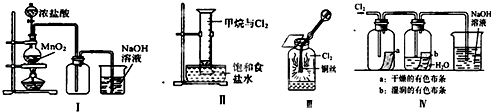
��Ŀ����
����Ŀ�������������壨FeC2O42H2O����һ��dz��ɫ���壬������ˮ�������ֽ⣬������﮵�ص�ԭ���ϣ�Ҳ�����������Լ�����Ӱ���ȣ����Ʊ��������£�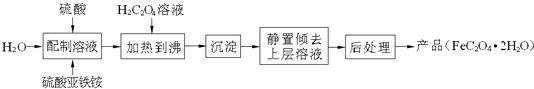
��1�����ƣ�NH4��2Fe��SO4��26H2O��Һʱ������������ᣬĿ���� ��
��2������ʱ������Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʢ�в�������������Թ��е��뼸�������ữ��KMnO4��Һ����������Һ����ɫ���Ϻ�ɫ��Ϊ�ػ�ɫ��ͬʱ���������ɣ���˵����������������������������ԭ�����ԣ�����Ӧ������1mol FeC2O42H2O����μӷ�Ӧ��n��KMnO4��Ϊ ��
��4����ȡ3.60g�����������壨Ħ��������180gmol��1�������ط���������ȷֽ⣬�õ�ʣ������������¶ȱ仯��������ͼ��ʾ��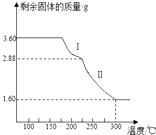
�ٹ��̢�����Ӧ�Ļ�ѧ����ʽΪ ��
��300��ʱʣ�����������һ���������ͨ������ȷ����������Ļ�ѧʽ��д��������̣���
���𰸡�
��1������Fe2+ˮ��
��2����NH4��2Fe��SO4��2+H2C2O4+2H2O=FeC2O4?2H2O��+H2SO4+��NH4��2SO4
��3����ԭ��0.6mol
��4��FeC2O4?2H2O ![]() FeC2O4+2H2O���������������е���Ԫ������Ϊ��3.6g��
FeC2O4+2H2O���������������е���Ԫ������Ϊ��3.6g�� ![]() ��100%=1.12g���������������е���Ԫ����ȫת�����������У� ����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��100%=1.12g���������������е���Ԫ����ȫת�����������У� ����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��Ԫ�غ���Ԫ�ص�������Ϊ��1.12g��0.48g=7��3��
������������Ļ�ѧʽΪFexOy ��
����56x��16y=7��3��
x��y=2��3��
����������Ļ�ѧʽΪFe2O3 ��
���������⣺��1�����ƣ�NH4��2Fe��SO4��26H2O��Һʱ����Һ����������ˮ�������ԣ�������������Ŀ����������ˮ�⣬���Դ��ǣ�����Fe2+ˮ�⣻��2������ʱ������Ӧ������������Һ�м�����ᷴӦ���ɲ���������������������ᰱ����Ӧ�Ļ�ѧ����ʽ����ԭ���غ���ƽд��Ϊ����NH4��2Fe��SO4��2+H2C2O4+2H2O=FeC2O42H2O��+H2SO4+��NH4��2SO4 �� ���Դ��ǣ���NH4��2Fe��SO4��2+H2C2O4+2H2O=FeC2O42H2O��+H2SO4+��NH4��2SO4����3����ʢ�в�������������Թ��е��뼸�������ữ��KMnO4��Һ����������Һ��ɫ��Ϊ�ػ�ɫ������CO2���ɣ�˵����������������Ϊ�����ӡ�������̼���壬�����������л�ԭ�ԣ����ݵ����غ����õ����ĵĸ���������ʵ���������������ԭ��Ӧ�����غ�ԭ���غ���ƽ��д���ӷ���ʽΪ5Fe2++5C2O42��+3MnO4��+24H+=5Fe3++3Mn2++5CO2��+12H2O������1mol FeC2O42H2O����μӷ�Ӧ��KMnO4Ϊ0.6mol�����Դ��ǣ���ԭ�ԣ�0.6����4����ͨ��ʣ������������֪�����̢����ķ�Ӧ�ǣ�����������������ʧȥ�ᾧˮ����Ӧ�Ļ�ѧ����ʽΪ��FeC2O42H2O ![]() FeC2O4+2H2O���Դ��ǣ�FeC2O42H2O
FeC2O4+2H2O���Դ��ǣ�FeC2O42H2O ![]() FeC2O4+2H2O���ڲ������������е���Ԫ������Ϊ��3.6g��
FeC2O4+2H2O���ڲ������������е���Ԫ������Ϊ��3.6g�� ![]() ��100%=1.12g���������������е���Ԫ����ȫת�����������У� ����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��100%=1.12g���������������е���Ԫ����ȫת�����������У� ����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��Ԫ�غ���Ԫ�ص�������Ϊ��1.12g��0.48g=7��3��
������������Ļ�ѧʽΪFexOy ��
����56x��16y=7��3��
x��y=2��3��
����������Ļ�ѧʽΪFe2O3 ��
���Դ��ǣ�Fe2O3 ��

����Ŀ��������ͼװ��̽���¶ȶ�����ԭFe2O3��Ӱ�죨�̶�װ���ԣ���
���������գ�
��1��ʵ��ʱA���д����Ϻ�ɫ����������������Ҫ�ɷ���NH3��H2��I2��HI������ͼװ���У���ʯ�ҵ���������
��2��װ��B�У�Zn����I2������Ӧ���䷴Ӧ��ѧ����ʽ��
��3������ͼװ�ý��жԱ�ʵ�飬�����þƾ��ơ������þƾ���ƶ�װ��C���ȣ���Ӧ�����Ϊ��ɫ��ĩ�������������ֱ��ø��ԵIJ����������̽�������������գ�
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ����ϡ���� | �ܽ⣬������ | �ܽ⣬������ |
2 | ȡ����1����Һ���μ�KSCN��Һ | ��� | �����Ա仯 |
3 | ����2��Һ�еμ�������ˮ | ��ɫ�ȱ������ȥ | �ȱ���Ҳ��ɫ |
����õ��ĺ�ɫ��ĩ��������1�����з�Ӧ�����ӷ���ʽΪ��
��4����װ��C�з�Ӧ��Ĺ�����Fe2O3��FeO��ɵĻ���Ϊȷ������ɣ�ȡ��Ʒ7.84�ˣ��ڼ��� ������ͨ�������İ�������ȫ��Ӧ��ֹͣ���ȣ�Fe2O3��FeO������ԭΪFe����Ӧ����������ȴ�Ƶ�����Ϊ5.6�ˣ���������Fe2O3��FeO�����ʵ���֮��Ϊ ��