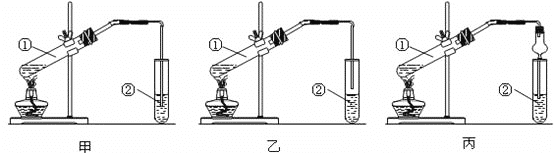
题目内容
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
(1)D元素在周期表中的位置为______________。
(2)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的是_________(写化学式)。
(4)F与G的氢化物中稳定的是________(写化学式)。
(5)B的单质在F的单质中燃烧所形成化合物的电子式为________。
(6)写出实验室制备E的最简单氢化物的化学方程式_____________________________。
【答案】 第二周期(或第2周期)第ⅣA族 r(N3-) > r(O2-)>r(Na+)(或N3- >O2- > Na+) Cl2 或O3 H2O ![]() 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】A~H为八种短周期主族元素,C元素形成的单质有“国防金属”的美誉,C为Mg;E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物,E为N元素,结合元素在周期表的位置可知,A为Li,B为Na,D为C,F为O,G为S,H为Cl。(1)D为C,位于第二周期第ⅣA族;(2)具有相同电子排布的离子中,原子序数大的离子半径小;(3)氯气、臭氧均可用于水的杀菌消毒;(4)F为O,G为S,H2O较稳定;(5)钠燃烧火焰为黄色,生成过氧化钠;(6)E为N元素,最简单氢化物为氨气。
(1)D元素在周期表中的位置为第二周期第ⅣA族;(2)B、E、F的简单离子半径由大到小的顺序为r(N3-)>r(O2-)>r(Na+)(或N3- >O2- > Na+);(3)上述元素所形成的气态单质中能用于饮用水消毒的是Cl2或O3;(4)F为O,G为S,同主族从上而下非金属性减弱,气态氢化物稳定性减弱,故H2O较稳定;(5)B的单质在F的单质中燃烧的火焰颜色为黄色,所形成化合物过氧化钠的电子式为![]() ;(6)E为N元素,最简单氢化物为氨气,实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2
;(6)E为N元素,最简单氢化物为氨气,实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |