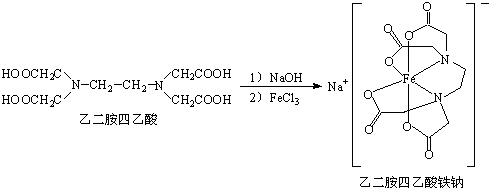
题目内容
3.25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=l×l06,下列叙述正确的是( )| A. | 该溶液中由水电离出的c(H+)=l×10-13mol/L | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+) | |
| D. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
分析 0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=l×l06,结合c(OH-)×c(H+)=l0-14,可知c(H+)=l×10-4 mol/L,c(OH-)=l×10-10 mol/L,由此可知HA为弱酸,以此解答该题.
解答 解:A.0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=l×l06,则c(H+)=l×10-4 mol/L,c(OH-)=l×10-10 mol/L,由此可知HA为弱酸,水电离出的c(H+)=c(OH-)=1×10-10 mol/L,故A错误;
B.根据溶液的电中性可知溶液中存在c(H+)+c(Na+)=c(OH-)+c(A-),故B正确;
C.由pH=4的HA与pH=10的NaOH溶液等体积混合后溶液呈酸性,故C错误;
D.浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,说明溶液中HA的电离大于A-离子的水解,溶液中c(Na+)>c(HA),故D错误;
故选B.
点评 本题考查弱电解质在溶液中的电离,题目难度不大,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14. (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
元素M的名称是铝.
(2)不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,下面是某些短周期元素电负性:
①通过分析电负性变化规律,确定Mg的电负性(用x表示)最小取值范围:0.9<x<1.57.
②某有机化合物结构式为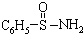 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
③已知元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.Be和F离子键,Si和Cl共价键.
(3)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3A═2Na3AlF6+3CO2↑+9H2O
①反应物A的化学式为 Na2CO3,属于离子晶体
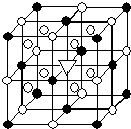
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,“●”位于大立方体顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处“▽”所代表的微粒是Na+(填具体的微粒符号)
③若Na3AlF6的摩尔质量为Mg/mol,若该晶胞的边长为acm,密度为ρg/cm3,设NA表示阿伏伽德罗常数,则NA=$\frac{4M}{ρ{a}^{3}}$/mol(用M、a、ρ表示).
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(2)不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,下面是某些短周期元素电负性:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
②某有机化合物结构式为
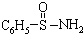 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)③已知元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.Be和F离子键,Si和Cl共价键.
(3)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3A═2Na3AlF6+3CO2↑+9H2O
①反应物A的化学式为 Na2CO3,属于离子晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,“●”位于大立方体顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处“▽”所代表的微粒是Na+(填具体的微粒符号)
③若Na3AlF6的摩尔质量为Mg/mol,若该晶胞的边长为acm,密度为ρg/cm3,设NA表示阿伏伽德罗常数,则NA=$\frac{4M}{ρ{a}^{3}}$/mol(用M、a、ρ表示).
11.下列叙述正确的是( )
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
18.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法错误的是( )
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
15.2006年10月18日《钱江晚报》报道:美国劳伦斯-利弗莫尔国家实验室16日宣布,美国与俄罗斯科学家合作,成功地合成了3个118号超重元素原子并观察到其存在.这种超重元素只能持续存在极短的时间,约有0.9毫秒,之后即迅速衰变为原子量较小的其他元素.下列有关说法正确的是( )
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
12.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理,下列叙述正确的是( )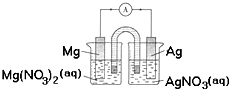

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |