题目内容
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。

①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。

【答案】N2O2(g)+O2(g)![]() 2NO2(g) ΔH2=ΔH-ΔH1 300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小
2NO2(g) ΔH2=ΔH-ΔH1 300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小 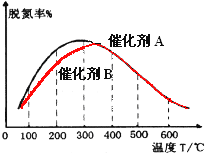 1.5≤x<2 (5-2x)︰(2x-3) 2NOx+4xe-=N2+2xO2-
1.5≤x<2 (5-2x)︰(2x-3) 2NOx+4xe-=N2+2xO2-
【解析】
(1)根据盖斯定律可知总反应式减去①即得到反应②N2O2(g)+O2(g)![]() 2NO2(g)ΔH2=ΔH-ΔH1;
2NO2(g)ΔH2=ΔH-ΔH1;
(2)①由于300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小,因此300℃之后脱氮率减小。
②根据图像可知催化剂B的催化效率低于催化剂A,达到平衡的时间长,故在更高的温度下才能达到平衡,由于正反应是放热反应,在较高的温度下的平衡状态中脱氮率较小,到达平衡后脱氮率不再受催化剂影响,则其他条件相同时,在催化剂B作用下脱氮率随温度变化的曲线为 。
。
(3)①平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,根据反应NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O可知只要n(NO2)︰n(NO)≥1时混合气体才能完全被吸收。当n(NO2)︰n(NO)=1时,x=1.5,如果全部是NO2,x=2,所以x的取值范围为1.5≤x<2。
②根据氧化还原反应中电子得失守恒以及原子守恒可知反应的化学方程式为2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,因此反应后溶液中n(NO2-)︰n(NO3-)=(5-2x)︰(2x-3)。
(4)电解池阴极发生得到电子的还原反应,根据装置图可知阴极是NOx得到电子,所以反应为2NOx+4xe-=N2+2xO2-。

【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1