题目内容
(6分)实验室蒸馏石油时:
(1)装置中温度计的水银球应插到 处,以控制 的温度;
(2)蒸馏烧瓶中加入碎瓷片的目的是 ;
(3)冷凝管中水的进出位置是 ,原因是 ;
(4)利用该套装置,可进行的实验是 。
① 用河水或井水制取蒸馏水 ② 除去食盐水里的少量Ca2+、Mg2+
③ 完全除去水中溶解的CO2。
(1)装置中温度计的水银球应插到 处,以控制 的温度;
(2)蒸馏烧瓶中加入碎瓷片的目的是 ;
(3)冷凝管中水的进出位置是 ,原因是 ;
(4)利用该套装置,可进行的实验是 。
① 用河水或井水制取蒸馏水 ② 除去食盐水里的少量Ca2+、Mg2+
③ 完全除去水中溶解的CO2。
(6分)(1)蒸馏烧 瓶支管口的附近; 蒸气; (2)防止液体瀑沸;
瓶支管口的附近; 蒸气; (2)防止液体瀑沸;
(3)进水在下,出水在上; 利用逆流原理,提高冷却效率; (4)①
 瓶支管口的附近; 蒸气; (2)防止液体瀑沸;
瓶支管口的附近; 蒸气; (2)防止液体瀑沸; (3)进水在下,出水在上; 利用逆流原理,提高冷却效率; (4)①
略

练习册系列答案
相关题目
 、
、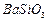 、
、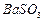 、
、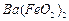 等]。某化工厂主要生产
等]。某化工厂主要生产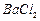 、
、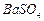 ,现利用钡泥制取
,现利用钡泥制取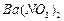 ,其部分工艺流程如下:
,其部分工艺流程如下: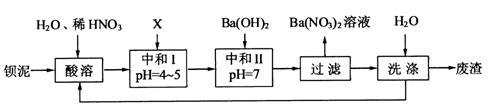
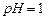 ,
,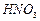 的反应化学方程式为 。
的反应化学方程式为 。 Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
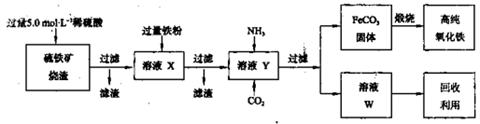
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。