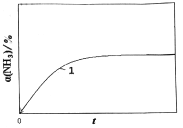
题目内容
【题目】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为________________(填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;
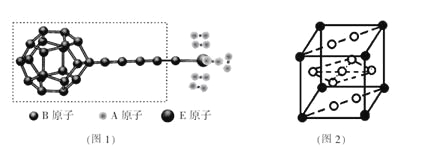
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H20 B. CH4C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为 ;已知其摩尔质量为Mg.mol-1,晶胞参数为apm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
【答案】(1)3d24s2(2)O>N>C>H
(3)分子晶体;配位键![]()
(4)①3种;BC ②LaNi5
【解析】试题分析:A的质子数、电子层数、最外层电子数均相等,A为氢元素;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,B为碳元素;D的基态原子核外成对电子数是成单电子数的3倍,D为氧元素,可推出C为氮元素;E4+与氩原子的核外电子排布相同,E为钛元素; F是第四周期d区原子序数最大的元素,F为锌元素;(1) 钛的价层电子排布式3d24s2。
(2)H、C、N、O电负性由大到小的顺序为O>N>C>H。
(3)Zn(CO)4,熔点、沸点低,所以该晶体的类型为分子晶体; Zn与CO之间的作用力为配位键。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种;
②N、O、F分别与H原子可能形成氢键,C、H原子不能形成氢键;氟化氢分子不能通过氢键形成笼状,X一定不是CH4;HF。
③晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.根据均摊原则,所以晶胞实际含有的镍原子为1+8×![]() =5,晶胞实际含有的镧原子为8×
=5,晶胞实际含有的镧原子为8×![]() =1,所以晶体的化学式Ni5La;晶胞的质量为
=1,所以晶体的化学式Ni5La;晶胞的质量为![]() ,根据ρ=
,根据ρ=![]() ,V=a3
,V=a3![]() ,则ρ=
,则ρ=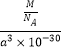 =
=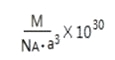 。
。

【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。