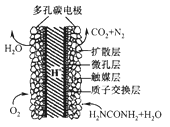
题目内容
【题目】下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I的产量是衡量一个国家化工生产水平的重要标志(图中部分反应物和生成物没有列出)。
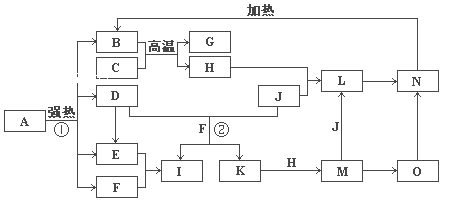
请按要求回答:
⑴写出G、L的化学式G:______,L:____________。
⑵反应②的离子方程式 ___________________________。
⑶反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为
1∶1∶1∶14,则该反应的化学方程式为 ________________________。
⑷将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为 ______________________________________________。
【答案】 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】C、H是日常生活中最常见的单质,且相互间能发生置换反应:“C+B→G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O。
(1)由以上分析可知G为Al2O3,L为FeCl3;(2)反应②是二氧化硫和氯气在水溶液中反应,离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-;(3)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式为FeSO47H2O,配平化学方程式得到:2(FeSO47H2O)![]() Fe2O3+SO2↑+SO3↑+14H2O;(4)A为FeSO47H2O,具有还原性,易被空气中氧气氧化为Fe3+,敞口久置,Fe3+水解生成Fe(OH)3,反应的离子方程式为12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓。
Fe2O3+SO2↑+SO3↑+14H2O;(4)A为FeSO47H2O,具有还原性,易被空气中氧气氧化为Fe3+,敞口久置,Fe3+水解生成Fe(OH)3,反应的离子方程式为12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓。

【题目】铁粉、铜粉混合物样品11.6 g,逐滴加入2.0 mol·L-1的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
请回答:
(1)样品中铁与铜的物质的量之比n(Fe)∶n(Cu)=________。
(2)在反应后的体系中,再加入4.0 mol·L-1的H2O2溶液25.0 mL,并加入足量硫酸溶液。充分反应后溶液中存在的各金属离子的物质的量分别是多少?__________________________________________。
【题目】小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体。教师结合小明已有知识设计了下图所示装置进行实验。
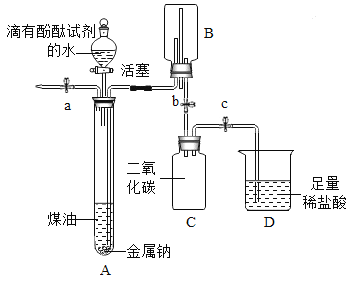
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL。
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是__________。
(2)实验过程
操作 | 现象及解释 | |
① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。 | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。由此可知金属钠的物理性质_______(写出一点即可)。 |
② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b。 | 反应的化学方程式为_____________. |
③ | 打开止水夹c。 | _______,溶液红色消失。 反应的化学方程式为_________。 |
④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯。 | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气。 |
(3)反思分析
金属钠与水反应的化学方程式为_____________;
反应结束,C中溶液的溶质是_________(指示剂除外,写出所有可能)。