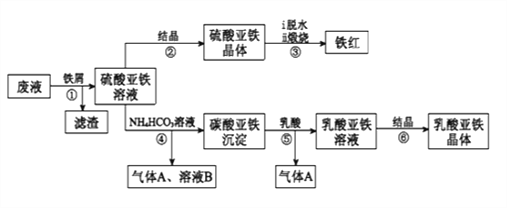
题目内容
【题目】下列实验操作正确的是( )
A.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
B.用10mL量筒量取8.58mL蒸馏水
C.容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大
D.用酒精萃取碘水中的I2
【答案】C
【解析】解:A.蒸发时,不能直接将溶液蒸干,当有大量晶体析出时,停止加热,用余热蒸干,故A错误;
B.10 mL量筒达不到0.01 mL的精确度,故B错误;
C.定容时俯视液面导致溶液的体积偏小,所配制溶液的物质的量浓度偏大,故C正确;
D.萃取剂应不溶于水,酒精与水混溶,不能用作萃取剂,故D错误.
故选C.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将乙烯分别通入溴水和酸性高锰酸钾溶液 | 溶液均褪色 | 二者反应类型相同 |
B | 对于密闭烧瓶中的已达到平衡的可逆反应:2NO2 | 混合气体颜色变深 | 加热该化学平衡可向正向移动 |
C | 某溶液中加入新制氢氧化铜悬浊液,加热 | 有砖红色沉淀生成 | 该溶液一定是葡萄糖溶液 |
D | 甲烷和氯气混合气体充入大试管中,倒立在水槽里,置于光亮处,过一段时间后,将试管从水槽中取出,向其中滴入几滴石蕊溶液 | 溶液变红 | 甲烷和氯气反应产物中有氯化氢 |
A. AB. BC. CD. D
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 | K1=9.1×10-8 | K1=7.5×10-3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变