题目内容
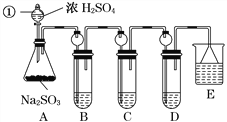
【题目】X溶液中只可能含有H+、Na+、NH4+、Cu2+、Al3+、Ag+、Fe3+、CO32-、NO3-、SO42-中的一种成几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
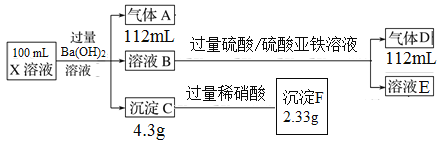
(1)X溶液中一定不存在的离子是________。
(2)加入过量H2SO4/FeSO4溶液时,发生反应的离子方程式为________。
(3)X溶液中c(CO32-)=_____mol/L,c(Na+)=______mol/L。
【答案】 H+、Cu2+、Al3+、Ag+、Fe3+ 3Fe2++4H++NO3-=3Fe3++N0↑+2H2O 0.1 0.4
【解析】分析:加入过量氢氧化钡生成气体A,则A为氨气,物质的量是0.112L÷22.4L/mol=0.005mol,说明溶液中一定存NH4+。生成沉淀C,C与稀硝酸反应剩余2.33g沉淀,因此沉淀C是硫酸钡和碳酸钡组成,其中硫酸钡是2.33g,物质的量是0.01mol,碳酸钡的质量是4.3g-2.33g=1.97g,物质的量是0.01mol,所以溶液中一定不存在H+、Cu2+、Al3+、Ag+、Fe3+,一定存在CO32-、SO42-。溶液B中加入硫酸酸化的硫酸亚铁溶液又产生气体D,说明溶液B中含有硝酸根,在酸性条件下把亚铁离子氧化,其还原产物是NO,物质的量是0.005mol,因此溶液中一定存在NO3-,结合电荷守恒判断是否存在钠离子。
详解:(1)由以上分析可知铵根是0.005mol,碳酸根和硫酸根均是0.01mol,根据D的物质的量是0.005mol,说明硝酸根的物质的量是0.005mol,因此根据溶液显电中性可知一定存在钠离子,物质的量是0.04mol,所以X溶液中一定不存在的离子是H+、Cu2+、Al3+、Ag+、Fe3+;
(2)加入过量H2SO4/FeSO4溶液时,发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++N0↑+2H2O。
(3)X溶液中c(CO32-)=0.01mol÷0.1L=0.1mol/L,c(Na+)=0.04mol÷0.1L=0.4mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案