题目内容
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
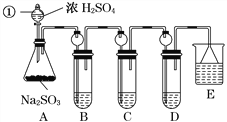
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
【答案】 分液漏斗 关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好 硫化氢溶液(或硫化钠、硫氢化钠溶液均可) 还原 SO2+Br2+2H2O=SO42-+4H++2Br- CaSO4 沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽生重复2到3次以上操作 过量(或适量)0.5 mol·L-1HCl 品红溶液 固体完全溶解,有气泡产生,且能使品红溶液褪色 Ca(ClO)2+2SO2+2H2O=CaSO4↓+H2SO4+2HCl NaOH溶液 吸收SO2,防止造成空气污染
【解析】根据强酸制弱酸的原理,实验室可用浓硫酸与亚硫酸钠来制取SO2气体。SO2具有漂白性、氧化性、还原性,本实验依次检验这3种性质。最后多余的SO2气体用碱吸收,为防止倒吸,使用倒扣漏斗吸收SO2。
(1)仪器①为分液漏斗。
(2)装置A为制取SO2气体,实验前须先检查气密性。对于分液漏斗型装置的的气密性的检查方法基本是一样的,方法为:关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好。
(3)SO2与氢硫酸反应生成硫单质,溶液变浑浊。SO2+2H2S=3S↓+2H2O反应中,SO2体现出氧化性,故B试管中盛放的是硫化氢水溶液或具有还原性的硫化钠或硫氢化钠溶液均可。答案为:硫化氢溶液(或硫化钠、硫氢化钠溶液均可) 。
(4)Br2水有强氧化性,能 将SO2氧化为H2SO4,本身被还原为HBr,溴水颜色褪去,可以证明SO2具有还原性,发生的反应为:SO2+Br2+2H2O =H2SO4+2HBr,故答案为:还原性 ;离子方程式为SO2+Br2+2H2O=SO42-+4H++2Br-
(5)①漂白粉的成分为CaCl2、Ca(ClO)2,根据强酸制弱酸的原理,SO2可与Ca(ClO)2反应生成CaSO3沉淀和弱酸HClO。CaSO3具有还原性,HClO具有氧化性,CaSO3可被氧化为沉淀CaSO4,故假设二,沉淀可能为CaSO4。②沉淀的洗涤是化学实验操作中的一个重点。洗涤的方法为:沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽生重复2到3次以上操作。根据SO32-可与酸反应生成具有漂白性的SO2气体,通过SO2能使品红褪色的原理可以判断是否含SO32-。用另一只干净试管取少量沉淀样品,加入过量0.5 mol·L-1HCl(不能加硫酸,否则又生成不溶的硫酸钙,那可能是假设3),将导管的另一端插入盛有品红该溶液的试管中,若出现固体完全溶解,出现气泡,且品红该溶液褪色的现象,即可证明沉淀为CaSO3,假设一成立。③Ca(ClO)2具有氧化性,将SO2氧化成SO42-,发生的反应为:Ca(ClO)2+2SO2+2H2O=CaSO4↓+H2SO4+2HCl
(6)SO2属于污染大气的气体,不能排放在空气中。SO2属于酸性氧化物,故E中用NaOH溶液 吸收多余的SO2,防止污染环境,造成大气污染。

 阅读快车系列答案
阅读快车系列答案【题目】(14分)中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。
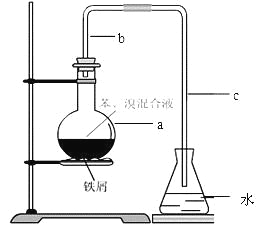
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入 ;但该实验不够严密,为此必须在导管a、b之间加上一盛有 的洗气瓶,目的是 。