题目内容
【题目】碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的电子排布图为___,CO2属于___分子(选填“极性”或“非极性”);
(2)60克SiO2晶体中含有的Si-O键数目为___(用NA表示);
(3)有机物M( )中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
)中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
(4)碳元素能形成多种单质如金刚石、石墨、C60等,回答下列问题:
(Ⅰ)C60的晶体类型是__晶体。
(Ⅱ)石墨是一种混合晶型,结构中具有的作用力有___。
a.共价键 b.分子间作用力 c.氢键 d.金属键 e.离子键
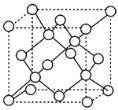
(Ⅲ)金刚石晶胞结构如图所示,假设金刚石晶胞的边长为a cm,阿伏伽德罗常数为NA,则金刚石的密度可以表示为___g/cm3。
【答案】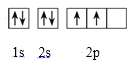 非极性 4NA sp2、sp3杂化 N>O>C 分子 abd
非极性 4NA sp2、sp3杂化 N>O>C 分子 abd ![]()
【解析】
(1)基态碳原子的电子排布式为1s22s22p2,其电子排布图为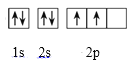 ,CO2是直线形分子,正负电荷中心重合,属于非极性分子;
,CO2是直线形分子,正负电荷中心重合,属于非极性分子;
(2)60克SiO2晶体为1mol,在SiO2晶体中,每个硅原子都连有4个氧原子,所以1mol SiO2晶体含有的Si-O键数目为4NA;
(3) 中苯环上的碳原子是sp2杂化,支链上的碳原子是饱和碳原子,为sp3杂化;由于氮原子的2p上有3个电子,是稳定的半充满结构,失去一个电子比较困难,所以C、N、O的第一电离能由大到小的顺序为N>O>C;
中苯环上的碳原子是sp2杂化,支链上的碳原子是饱和碳原子,为sp3杂化;由于氮原子的2p上有3个电子,是稳定的半充满结构,失去一个电子比较困难,所以C、N、O的第一电离能由大到小的顺序为N>O>C;
(4)(Ⅰ)C60的晶体类型是分子晶体;
(Ⅱ)石墨是层状结构,在同层内,碳原子通过sp2杂化和另外三个碳原子形成共价键,层和层之间是微弱的范德华力,同时每个碳原子还有一个未杂化的电子,可以自由移动,所以石墨中具有的作用力有共价键、分子间作用力和金属键,故选abd;
(Ⅲ)一个金刚石晶胞中有8(=8×![]() +6×
+6×![]() +4×1)个碳原子,则一个晶胞的质量为
+4×1)个碳原子,则一个晶胞的质量为![]() g,所以金刚石的密度可以表示为
g,所以金刚石的密度可以表示为![]() g/cm3。
g/cm3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D