题目内容
16.中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出).单质A常作为食品包装材料,甲是两性氧化物.根据图示转化关系回答: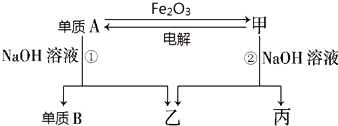
(1)写出反应①的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出单质A与Fe2O3反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,除铝热剂外,该反应还需加入镁粉和氯酸钾,利用该反应的原理,可用于焊接钢轨等.
(3)设计一个简单的实验方案,证明上述A与Fe2O3反应所得的块状熔融物中含有单质A.取少量块状熔融物于烧杯中,加入氢氧化钠溶液,若有气泡冒出,则证明含有单质铝.
分析 单质A常作为食品包装材料,甲是两性氧化物,A与氧化铁反应得到甲,且A能与NaOH反应,则A为Al,甲为Al2O3,单质B为H2,乙为NaAlO2,丙为NaAlO2,据此解答.
解答 解:单质A常作为食品包装材料,甲是典型的两性氧化物,A与氧化铁反应得到甲,且A能与NaOH反应,则A为Al,甲为Al2O3,单质B为H2,乙为NaAlO2,丙为NaAlO2,
(1)反应①的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)A为金属Al,单质A与Fe2O3反应为铝热反应,铝热反应需要引发剂引发高温反应,镁条在空气中可以燃烧,氧气是氧化剂,但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,铝热反应的应用为焊接钢轨等,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;镁粉和氯酸钾;焊接钢轨等;
(3)铝能与氢氧化钠反应生成偏铝酸钠和氢气,据此可设计一个简单的实验方案,证明铝热反应的产物中含有单质铝,具体操作为取少量块状熔融物于烧杯中,加入氢氧化钠溶液,若有气泡冒出,则证明含有单质铝,
故答案为:取少量块状熔融物于烧杯中,加入氢氧化钠溶液,若有气泡冒出,则证明含有单质铝.
点评 本题考查无机物推断,涉及Al元素化合物性质、铝热反应、金属冶炼、离子方程式书写等,难度不大,需要学生熟练掌握元素化合物性质,比较基础.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
6.下列说法正确的是( )
| A. | 根据醋酸溶液中分子和离子共存,即可证明溶液达到了电离平衡状态 | |
| B. | c(CH3COO-)=c(H+),则醋酸溶液达到电离平衡状态 | |
| C. | 当NH3•H2O达到电离平衡时,溶液中NH3•H2O和OH-的浓度肯定相等 | |
| D. | 磷酸是分步电离的,电离程度依次减弱 |
7.下列关于药物的使用说法正确的是( )
| A. | 随着药店的普及,药物都可以直接去药店购买,不需要去医院 | |
| B. | 青霉素时一种常用药,感冒发烧、咳嗽肺炎都可以使用 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 虽然药物能治病,但大部份药物有毒副作用 |
4.下列属于离子化合物的是( )
| A. | N2O | B. | Na | C. | HCl | D. | KCl |
11.用下列实验装置或操作进行的实验能达到实验目的是( )
| A. | 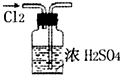 干燥Cl2 干燥Cl2 | B. | 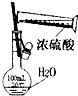 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 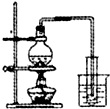 制取少量蒸馏水 | D. |  检验钾元素的存在 |
1.下列化学反应中,离子方程式表示正确的是( )
| A. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| B. | 铁粉加到盐酸中:2Fe+6H+=Fe3++3H2↑ | |
| C. | 石灰石溶解在稀HCl中:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++2OH-+SO42-+2H+═2H2O+BaSO4↓ |
8.实验是学习化学的有效工具,下列实验操作正确的是( )
| A. | 采用直接加热绿矾(FeSO4•xH2O)晶体的方法制备无水硫酸亚铁 | |
| B. | 用KMnO4标准溶液滴定H2C2O4溶液时,眼睛时刻关注着锥形瓶内溶液颜色变化 | |
| C. | 在中和热测定实验中,为保证稀盐酸充分反应,将氢氧化钠溶液应分少量多次加入 | |
| D. | 为测定新制氯水pH,用玻璃棒蘸取液体滴在pH试纸上,再对照标准比色卡读数 |
4.在容积固定为2L的密闭容器中,充入0.180molHI,480℃时反应:2HI(g)?H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅.
(1)0~2min内H2的平均反应速度为0.002mol/(L•min).达平衡时,HI的转化率是22.2%.
(2)当上述反应达平衡时,降低温度,原化学平衡向逆向移动(填“正向”,“逆向”或“不”),上述正向反应是:吸热反应(选填:放热、吸热),逆反应速率减小(填“增大”、“减小”或“不变”).
(3)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为49.
(4)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是D(选填字母).
A.增大HI起始浓度 B.向混合气体中通入I2 C.使用高效催化剂 D.升高温度.
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
(1)0~2min内H2的平均反应速度为0.002mol/(L•min).达平衡时,HI的转化率是22.2%.
(2)当上述反应达平衡时,降低温度,原化学平衡向逆向移动(填“正向”,“逆向”或“不”),上述正向反应是:吸热反应(选填:放热、吸热),逆反应速率减小(填“增大”、“减小”或“不变”).
(3)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为49.
(4)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是D(选填字母).
A.增大HI起始浓度 B.向混合气体中通入I2 C.使用高效催化剂 D.升高温度.
 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:
可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答: