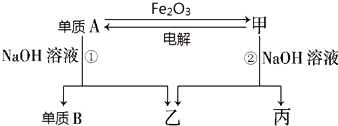
题目内容
5.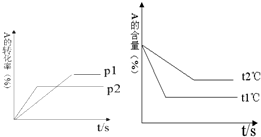 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:
可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:①压强 P1<P2;(a+b)<(c+d)(填“>”或“<”下同).
②温度t1℃>t2℃;△H>0.
③保持体积和温度不变,通入He,平衡会不移动(填“正向”、“逆向”或“不”).
分析 根据先拐先平衡判断:t1>t2,p2>p1.温度升高,A的百分含量减小,说明平衡正向移动,△H>0,增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,以此解答该题.
解答 解:①由图象可知时P2先达到平衡,说明P2压强较大,反应速率较大,则压强 P1比P2小,增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,则(a+b)比(c+d)小,故答案为:<;<;
②由图象可知t1℃时先达到平衡,温度较高,则温度t1℃比t2℃高,温度升高,A的百分含量减小,说明平衡正向移动,△H>0,故答案为:>;>;
③保持体积和温度不变,通入He,反应物和生成物的浓度不变,所以平衡不移动,故答案为:不.
点评 本题考查化学平衡图象问题,注意根据图象的曲线变化趋势判断,特别是注意外界条件对平衡移动的影响与反应方程式的关系.

练习册系列答案
相关题目
15.下列实验操作中不正确的是( )
| A. | 蒸发操作时,当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 | |
| B. | 过滤后洗涤沉淀,是将水沿玻璃棒注入漏斗中,用玻璃棒搅拌后待水流下 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,它与原溶剂应不互溶 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 取2 L 1 mol/L AlCl3溶液,其所含Al3+的数目为2NA | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,盐酸所消耗氢氧化钠更少 | |
| C. | 在一定的温度和催化剂条件下,1.6g O2和足量SO2反应转移电子数为0.2NA | |
| D. | 溶质的物质的量相同的Na3PO4溶液和H3PO4溶液中PO43-的数目前者大于后者 |
20.一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g),进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3h):
请回答下列问题:
(1)该反应的平衡常数表达式为$\frac{[N{H}_{3}]^{2}×[{O}_{2}]^{\frac{3}{2}}}{[{N}_{2}]×[{H}_{2}O]^{3}}$.
(2)已知在所给条件下投入1molN2和3molH2O(l),当反应达到平衡时消耗了35kJ的热量,并收集到0.4molNH3.则N2的平衡转化率为20%,该反应的热化学方程式可表示为N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+175.0kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢,请提出可提高其反应速率同时增大NH3生成量的措施升高温度、增大氮气浓度.(列出两种即可)
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.在某体积为10L的恒温恒容密闭容器中加入2mol N2和4mol H2,2min后反应达到平衡时容器内的压强是起始压强的2/3.求:
①2min内NH3的反应速率υ(NH3)=0.1 mol/(L•min).
②下列有关该化学反应的说法正确的是B(填字母序号).
A.在恒温恒压条件下,向上述平衡体系中通入少量氩气,平衡不移动
B.在恒温恒容条件下,向上述平衡体系中通入少量氩气,平衡不移动
C.实际工业生产中为提高H2的转化率,通常通入过量的N2,且N2过量越多越好
D.当温度、体积相同且恒定不变时,向甲容器中通入0.5mol N2和1.5mol H2,乙容器中通入1mol N2和3molH2,后者反应放出的热量为前者的两倍.
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)该反应的平衡常数表达式为$\frac{[N{H}_{3}]^{2}×[{O}_{2}]^{\frac{3}{2}}}{[{N}_{2}]×[{H}_{2}O]^{3}}$.
(2)已知在所给条件下投入1molN2和3molH2O(l),当反应达到平衡时消耗了35kJ的热量,并收集到0.4molNH3.则N2的平衡转化率为20%,该反应的热化学方程式可表示为N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+175.0kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢,请提出可提高其反应速率同时增大NH3生成量的措施升高温度、增大氮气浓度.(列出两种即可)
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.在某体积为10L的恒温恒容密闭容器中加入2mol N2和4mol H2,2min后反应达到平衡时容器内的压强是起始压强的2/3.求:
①2min内NH3的反应速率υ(NH3)=0.1 mol/(L•min).
②下列有关该化学反应的说法正确的是B(填字母序号).
A.在恒温恒压条件下,向上述平衡体系中通入少量氩气,平衡不移动
B.在恒温恒容条件下,向上述平衡体系中通入少量氩气,平衡不移动
C.实际工业生产中为提高H2的转化率,通常通入过量的N2,且N2过量越多越好
D.当温度、体积相同且恒定不变时,向甲容器中通入0.5mol N2和1.5mol H2,乙容器中通入1mol N2和3molH2,后者反应放出的热量为前者的两倍.
10.下列每组反应一定能用同一离子方程式表示的是( )
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na、Mg分别与稀盐酸反应 |
17.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| C. | 常温常压下,1mol丙烷所含有的共价键数目为11NA | |
| D. | 0.5mol 1,3一丁二烯分子中含有的碳碳双键数为NA |