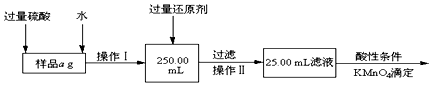
题目内容
16.下列实验操作正确的是( )| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
分析 A.互不相溶的液体采用分液的方法分离,酒精与水混溶;
B.分液时,分液漏斗中上层液体从上口倒出,为防止含有杂质,下层液从下口倒出;
C.NaOH固体具有强腐蚀性,易潮解;
D.有活塞或连接的装置使用前要检漏.
解答 解:A.酒精与水混溶,不能用作萃取剂,应用苯或四氯化碳等,故A错误;
B.分液时应避免液体重新混合而污染,应使下层液体从下端流出,上层液体则从上口倒出,故B正确;
C.NaOH固体具有强腐蚀性,易潮解,应放玻璃容器中称量,且应“作物右码”,故C错误;
D.分液漏斗使用前需检验是否漏水,漏液不能使用,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学实验基本操作、物质的分离、提纯等,侧重于学生的分析能力和实验能力的考查,注意把握相关实验的操作方法,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42- (黄色)
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
7.科学家正在研究利用催化技术将汽车尾气中的NO和CO转变成CO2和N2化学方程式如下:2NO(g)+2CO(g) $\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g)△H.
为了测定在某种催化剂作用下的反应速度,某温度下,在容积固体的容器内进行此反应,并用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在该反应的平衡常数的表达式K=$\frac{{{c^2}(C{O_2})•c({N_2})}}{{{c^2}(NO)•{c^2}(CO)}}$.
(2)该反应在此温度下能够自发进行,说明△H<0(填写“>”、“<”、“=”).
若只将反应条件改为绝热,平衡时NO的浓度将增大(填“增大”、“减小”、“不变”)
(3)前2s内的平均反应速率v(N21.88×10-4mol•L-1•s-1.
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
(5)请在上表空格中填入剩余的实验条件数据.
(6)请在给出的坐标图中,参考实验 I实验条件下混合气体中NO浓度随时间变化的趋势曲线图,画出 II、III条曲线图,并标明各条曲线的实验编号.
为了测定在某种催化剂作用下的反应速度,某温度下,在容积固体的容器内进行此反应,并用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在该反应的平衡常数的表达式K=$\frac{{{c^2}(C{O_2})•c({N_2})}}{{{c^2}(NO)•{c^2}(CO)}}$.
(2)该反应在此温度下能够自发进行,说明△H<0(填写“>”、“<”、“=”).
若只将反应条件改为绝热,平衡时NO的浓度将增大(填“增大”、“减小”、“不变”)
(3)前2s内的平均反应速率v(N21.88×10-4mol•L-1•s-1.
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | NO初始浓度 (mol/L) | C O初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| 1 | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| 2 | 124 | |||
| 3 | 350 | 124 |
(6)请在给出的坐标图中,参考实验 I实验条件下混合气体中NO浓度随时间变化的趋势曲线图,画出 II、III条曲线图,并标明各条曲线的实验编号.

11.电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
(1)根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式H++HSO4-+Ba2++2OH-=BaSO4+2H2O
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
8.已知R2+离子核外有a个电子,b个中子.表示R原子符号正确的是( )
| A. | ${\;}_{b}^{a}R$ | B. | ${\;}_{a-2}^{a+b-2}R$ | C. | ${\;}_{a+2}^{a+b+2}R$ | D. | ${\;}_{a-2}^{a+b}R$ |
5.根据表中信息判断,下列叙述正确的是( )
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
17.下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
| A. | 次氯酸钠水溶液具有强氧化性,故可用作消毒剂 | |
| B. | 氢氟酸能蚀刻玻璃,是利用氢氟酸的弱酸性 | |
| C. | 常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |