题目内容
11.电离度表示电解质的相对强弱,电离度的定义:α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
分析 (1)硫酸第一步电离是完全电离,第二步电离是不完全电离,溶液中存在大量硫酸氢根离子,硫酸氢根离子和氢氧化钡反应生成硫酸钡沉淀和水,根据离子方程式书写规则书写;
(2)c(H+)=c(酸)×α(电离度),注意硫酸分两步电离;
(3)硫酸溶液中,第一步电离出的氢离子抑制了第二步的电离;
(4)根据电离方程式和Ka的含义分析;根据c(H+)=cα,Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算.
解答 解:(1)硫酸第一步电离出氢离子和硫酸氢根离子,硫酸氢根离子电离较弱,在硫酸溶液中主要以硫酸氢根离子存在,氢氧化钡溶于水电离出的氢氧根离子和氢离子反应促进硫酸氢根离子电离,同时硫酸根离子和钡离子反应生成硫酸钡沉淀,所以离子反应方程式为:H++HSO4-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:H++HSO4-+Ba2++2OH-=BaSO4+2H2O;
(21)硫酸第一步完全电离,第二步部分电离,硫酸中c(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,c(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,c(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,c(H+)=0.1mol/L;
所以c(H+)由大到小的顺序是ADBC;
故答案为:ADBC;
(3)硫酸溶液中,硫酸第一步电离出氢离子,第二步又电离出氢离子,第一步电离出的氢离子抑制了第二步的电离,而硫酸氢钠溶液中硫酸氢根离子只有一步电离,所以.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度,
故答案为:H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度;
(4)醋酸在溶液中存在电离平衡:CH3COOH?CH3COO-+H+,则Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$;醋酸溶液中c(H+)=c(CH3COO-)=cα,则Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{cα×cα}{c-cα}$=$\frac{c{α}^{2}}{1-α}$=$\frac{0.1{α}^{2}}{1-α}$;
故答案为:K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$;$\frac{0.1{α}^{2}}{1-α}$.
点评 本题考查弱电解质的电离、电离平衡常数,注意硫酸实际上是分两步电离的,且第二步是不完全电离,为易错点,题目难度中等,侧重于考查学生对基础知识的应用能力.

| A. |  表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. |  表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 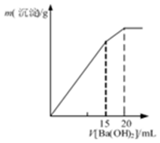 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. |  表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
| A. | 2.5mol | B. | 5mol | C. | 25mol | D. | 250mol |
| A. | 在常温常压下,11.2 L N2含有分子数为0.5 NA | |
| B. | 在常温常压下,22.4 L Ne含有分子数为NA | |
| C. | 71 g Cl2所含原子数为2 NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数相同 |
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 标况下O2的体积取决于O2分子间的距离 | |
| C. | 常温常压下4.9LO3含有的O约为9.6g | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
