题目内容
18.常温下,下列离子组在pH=1的溶液中不能大量共存的是( )| A. | Al3+、Na+、NO3-、Cl- | B. | Fe3+、Na+、C1-、NO3- | ||
| C. | K+、NH4+、Cl-、AlO2- | D. | Cu2+、NH4+、SO42-、NO3- |
分析 常温下,pH=1的溶液呈酸性,离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应、和氢离子不反应的能大量共存,据此分析解答.
解答 解:常温下,pH=1的溶液呈酸性,
A.这几种离子之间不反应且和氢离子不反应,所以能大量共存,故A不选;
B.这几种离子之间不反应且和氢离子不反应,所以能大量共存,故B不选;
C.NH4+、AlO2-发生水解反应而不能大量共存,且AlO2-和氢离子反应而不能大量共存,故C选;
D.这几种离子之间不反应且和氢离子不反应,所以能大量共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,侧重考查学生分析判断能力,明确离子性质及离子共存条件是解本题关键,题目难度不大,易错选项是C.

练习册系列答案
相关题目
8.在硫化钠水溶液中存在着多种离子和分子,下列关系式正确的是( )
| A. | c(S2-)+c(HS-)+c(H2S)+c(H+)=c(OH-) | B. | c(OH-)=c(HS-)+c(H+)+2 c(H2S) | ||
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S) | D. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
9.下列物质既具有氧化性又有还原性的是( )
①SO2 ②Fe3+ ③Fe2+ ④HCl ⑤H2O2.
①SO2 ②Fe3+ ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
6.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| B. | 在1mol的Na2O2晶体中离子总数为3NA | |
| C. | 在0.5mol/L NaCl溶液中,含有的Na+数目为0.5NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
3.
| 化学式 | 摩尔质量/(g•mol-1) | 质量/g | 物质的量/mol | 分子或离子数 |
| H2SO4 | 4.9 | |||
| SO2 | 0.5 | |||
| OH- | 6.02×1024 | |||
| NH4+ | 6.02×1022 |
2.某同学为了探究甲烷、乙烯和苯分别与卤素反应的情况,分别设计了以下3个实验,请回答下列问题.
Ⅰ.甲、乙两支试管分别盛甲烷和氯气的混合气体(以体积比1:1混合),其中一支用黑纸包好,将它们置于光线一般的室内,等待片刻,观察现象.请填写下表:
请写出CH4和Cl2在光照条件下发生反应,生成一氯取代产物的化学方程式CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl
Ⅱ.为探究乙烯与溴的加成反应,因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,该同学认为应先除去杂质,再通入溴水中.为此,他设计了如图所示的实验装置:
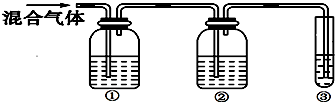
请回答:
(1)①、②、③装置中可盛放的试剂是:①A、②B、③C.(填序号)
A.NaOH溶液 B.品红 C.溴水 D.酸性高锰酸钾溶液
(2)除杂后,观察到溴水褪色,结合所学内容得出结论:乙烯可与溴水发生加成反应.请写出化学反应方程式CH2=CH2+Br2→ .
.
Ⅲ.为了探究苯与溴反应生成溴苯的实验,该同学采用下图所示装置,请分析装置并完成下列题目:

(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶中由A口加入过量溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为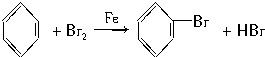
(2)D、E试管内出现的现象为石蕊溶液变红、出现淡黄色沉淀.
通过探究,该同学得出结论:甲烷、乙烯和苯在不同的条件下均能与卤素反应.
Ⅳ.现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用方程式表示出来(注意:原料不一定要全部选用).H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.
Ⅰ.甲、乙两支试管分别盛甲烷和氯气的混合气体(以体积比1:1混合),其中一支用黑纸包好,将它们置于光线一般的室内,等待片刻,观察现象.请填写下表:
| 实验现象 | 实验结论 | |
| 甲 | 在光照条件下,试管内气体颜色变浅了;试管内壁上出现了油状液滴. | CH4与Cl2在光照条件下 发生化学反应 |
| 乙 | 迅速剥开黑纸,立即观察,试管内气体颜色为黄绿色. | CH4与Cl2在无光照条件下不发生化学反应. |
Ⅱ.为探究乙烯与溴的加成反应,因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,该同学认为应先除去杂质,再通入溴水中.为此,他设计了如图所示的实验装置:

请回答:
(1)①、②、③装置中可盛放的试剂是:①A、②B、③C.(填序号)
A.NaOH溶液 B.品红 C.溴水 D.酸性高锰酸钾溶液
(2)除杂后,观察到溴水褪色,结合所学内容得出结论:乙烯可与溴水发生加成反应.请写出化学反应方程式CH2=CH2+Br2→
 .
.Ⅲ.为了探究苯与溴反应生成溴苯的实验,该同学采用下图所示装置,请分析装置并完成下列题目:

(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶中由A口加入过量溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为

(2)D、E试管内出现的现象为石蕊溶液变红、出现淡黄色沉淀.
通过探究,该同学得出结论:甲烷、乙烯和苯在不同的条件下均能与卤素反应.
Ⅳ.现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用方程式表示出来(注意:原料不一定要全部选用).H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.

 .
.