题目内容
【题目】氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:

Ⅰ、依据反应: 2Ag+(aq)+Cu=== Cu2+ (aq) +2Ag设计的原电池如图1所示。则电解质溶液Y是___________ (填化学式),X的电极反应式__________________。若将盐桥换成铜丝,则X电极名称是____________。
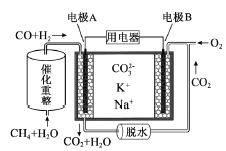
Ⅱ、 用图2的装置进实验。
(1)若A为Zn,实验时开关K与a连接,则能模拟钢铁的一种电化学防护方法,名称为______。
(2)若A为石墨,将开关K与b连接,则有关该实验的说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的蓝色石蕊试纸先变红后褪色
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
⑤电子流动方向:电源负极→B→饱和食盐水→A→电源正极
⑥若实验前滴入酚酞,B极区附近溶液先变红
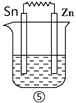
Ⅲ、 如下图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是______________。

【答案】 AgNO3 Cu-2e-=Cu2+ 阳极 牺牲阳极的阴极保护法 ②④⑥ ②>①>⑤>④>③
【解析】(1)若A为Zn,实验时开关K与a连接,构成原电池,锌是负极,铁正极,属于牺牲阳极的阴极保护法。(2)若A为石墨,将开关K与b连接,构成电解池,铁电极是阴极,溶液中的氢离子放电,石墨是阳极,氯离子放电,①溶液中Na+向阴极B极移动,①错误;②从A极处逸出的气体是氯气,能使湿润的蓝色石蕊试纸先变红后褪色,②正确;③反应一段时间后通入氯化氢可恢复到电解前电解质的浓度,③错误;④若标准状况下B极产生2.24 L气体,即氢气是0.1mol,则电路中转移0.2 mol电子,④正确;⑤电子不能通过溶液传递,⑤错误;⑥若实验前滴入酚酞,B极区附近产生氢氧化钠,溶液先变红,⑥正确,答案选②④⑥;
Ⅲ、金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,①中锌发生电化学腐蚀,金属锌是负极,加快锌的腐蚀;②中锌作电解池的阳极,被腐蚀;③中锌作电解池的阴极,被保护;④中Zn发生化学腐蚀;⑤中锌是负极,由于金属性铜大于锡,所以腐蚀速率由快到慢的顺序是②>①>⑤>④>③。