题目内容
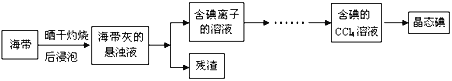
【题目】【上海市浦东新区六校2017届高三下学期第二次学科调研考试】工业上常用如下的方法从海水中提碘:

完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
【答案】 第三周期第ⅦA族 共价键 17 ![]() HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH
HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH ![]()
【解析】(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,位于周期表中第三周期第ⅤⅡA,氯气分子中氯原子间相处一对共用电子对,形成一个共价键,氯原子核外17个电子,其核外存在17种运动状态不同的电子,故答案为:第三周期第ⅤⅡA;共价键;17;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,电子式为,![]() ,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:
,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:![]() ;HF;HCl;
;HF;HCl;
(3)步骤②中用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,故答案为:沸点低,易挥发;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,反应中被氧化的元素是S元素,化合价+4价变化为+6价,故答案为:Br2+SO2+2H2O=H2SO4+2HBr;S;
(5)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大溶液中生成氢氧化钠,故答案为:H2;NaOH;
(6)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的化学方程式为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,溴元素0价变化为-1价和+5价,电子转移总数5e-,该反应的化学方程式并标明电子转移方向与数目为:![]() ,故答案为:
,故答案为:![]() 。
。
【名师点评】本题考查了海水资源及其综合利用,涉及的知识点较多。清楚流程中的反应原理是解题的关键。浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案