题目内容
【题目】下列说法正确的是( )
A. 如图可表示水分解过程中的能量变化

B. 增大反应物浓度,是增大了活化分子百分数使反应速率增大。
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: ![]() ,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
【答案】A
【解析】A. 水分解吸热,反应物总能量低于生成物总能量,催化剂降低活化能,反应热不变,图像正确,A正确;B. 增大反应物浓度,是增大了单位体积内活化分子百分数使反应速率增大,活化分子的百分数不变,B错误;C. 需要加热的反应不一定是吸热反应,常温下能发生的反应也不一定是放热反应,例如氢氧化钡晶体与氯化铵反应,C错误;D. 反应热等于断键吸收的能量和形成化学键所放出的能量的差值,设断开1molH-Cl键所需的能量为xkJ,则b+c-2x=-a,解得x=(a+b+c)/2,D错误,答案选A。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50mol/L KI、0.2%淀粉溶液、0.10molL﹣1K2S2O8、0.20molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82﹣+2I﹣=2SO42﹣+I2(慢) I2+2S2O32﹣=2I﹣+S4O62﹣ (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的_________耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,Na2S2O3与K2S2O8初始的体积v(Na2S2O3)与v(K2S2O8)量需满足的关系为:v(Na2S2O3)______v(K2S2O8)(填“>”,“<”,“=”),出现蓝色之前,I-在反应中起到的作用是_________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/ml | 出现蓝色的时间t/s | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | ||
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 | 10 |
② | 5.0 | V1 | 4.0 | 4.0 | 2.0 | 20 |
③ | 10.0 | V2 | 2.0 | 4.0 | 2.0 | 20 |
④ | 10.0 | V3 | 4.0 | 2.0 | 2.0 | 5 |
①表中V1________,V2_______,V3=______ .
②用K2S2O8表示实验序号①、②、④的速率分别为_____mol·L-1·s-1.
③根据实验结构,以下说法正确的有_____
A.该反应的速率与K2S2O8的浓度成正相关
B.该反应的速率与KI的浓度成正相关
C.该反应的速率与Na2S2O3的浓度成正相关
D.多步反应的速率由慢速反应速率决定
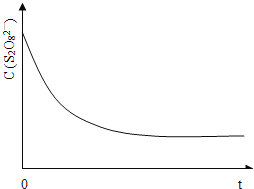
(3)已知某条件下,浓度c(S2O82﹣)随反应时间t的变化曲线如图,若保持其它条件不变,图中,分别画出降低反应温度和加入催化剂时c(S2O82﹣)随反应时间t的变化曲线示意图(进行相应的标注)_____.