题目内容
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
【答案】D
【解析】试题分析:首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型.
解:A.PCl3中P原子形成3个δ键,孤对电子数为![]() =1,则为sp3杂化,为三角锥形,故A正确;
=1,则为sp3杂化,为三角锥形,故A正确;
B.BCl3中B原子形成3个δ键,孤对电子数为![]() =0,则为sp2杂化,为平面三角形,故B正确;
=0,则为sp2杂化,为平面三角形,故B正确;
C.CS2中C原子形成2个δ键,孤对电子数为![]() =0,则为sp杂化,为直线形,故C正确;
=0,则为sp杂化,为直线形,故C正确;
D.H2S分子中,S原子形成2个δ键,孤对电子数为![]() =2,则为sp3杂化,为V形,故D错误.
=2,则为sp3杂化,为V形,故D错误.
故选D.

 名校课堂系列答案
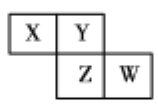
名校课堂系列答案【题目】如表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ A | Ⅶ A | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
I.(1)这10种元素中,化学性质最不活泼的元素是____(填元素符号,下同),非金属性最强的元素是___。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是____,有关反应的离子方程式为_____。
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是____;(填序号,下同)
(2)含有非极性键的离子化合物是____;
(3)不含化学键的是____;
(4)用电子式表示Na2O的形成过程_____。