题目内容
7.A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C 处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:(1)C在元素周期表的第三周期IVA族.
(2)五种元素中,形成最简单的非金属氢化物的稳定性由大到小的顺序是(用分子表示)H2O>NH3>CH4>SiH4.
(3)B、D形成的原子个数比为1:1的化合物的电子式是
 .
.(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2,肼的电子式
 .肼-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液.该燃料电池的正极的电极反应式是O2+2H2O+4e-═4OH-.
.肼-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液.该燃料电池的正极的电极反应式是O2+2H2O+4e-═4OH-.
分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,又A>E>B,可知E为N元素,以此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,又A>E>B,可知E为N元素,以此解答该题.
解答 解:A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,又A>E>B,可知E为N元素,
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,又A>E>B,可知E为N元素,
(1)C为Si元素,位于周期表第三周期IVA族,故答案为:三;IVA;
(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性:O>N>C>Si,故氢化物的稳定性为:H2O>NH3>CH4>SiH4,
故答案为:H2O>NH3>CH4>SiH4;
(3)B与D形成的原子个数比为1:1的化合物为Na2O2,其电子式是 ,故答案为:
,故答案为: ;
;
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2,分子式为N2H4,肼的电子式为 ,
,
正极发生还原反应,且电解质呈碱性,氧气得电子生成氢氧根离子,电极方程式为O2+2H2O+4e-═4OH-,
故答案为: ; O2+2H2O+4e-═4OH-.
; O2+2H2O+4e-═4OH-.
点评 本题考查位置结构性质的关系应用,为高考常见题型,侧重学生的分析能力的考查,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置,理解掌握同主族原子序数关系.

| A. | 碳氢化合物的通式为CnH2n+2 | B. | 芳香烃属于碳氢化合物 | ||
| C. | 乙炔是含碳量最高的碳氢化合物 | D. | 溴苯属于碳氢化合物 |
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入少量水中 | |
| C. | 把一段打磨过的镁带放入少量冷水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
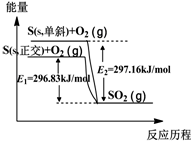
| A. | 单斜硫和正交硫互为同素异形体 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 由单斜硫制取正交硫是一个放热反应 |
| A. | KCl和K2O都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
| A. | 原子间通过共用电子对所形成的化学键叫共价键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 对双原子分子来讲,键能越大,含有该键的分子越稳定 | |
| D. | 键长越长,化学键越牢固 |

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
