题目内容
2.下列关于σ键和π键的理解不正确的是( )| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | HBr 分子中的σ键是s-p σ键,Cl2分子中的σ键是p-p σ键 | |
| D. | 气体单质中一定存在σ键,可能存在π键 |
分析 分子中单键中只含σ键,双键和三键中含π键和σ键,σ键为球对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,稀有气体是单原子分子,分子中不存在共价键,以此解答该题.
解答 解:A.分子中单键中只含σ键,双键中含1个π键和1个σ键和三键中含2个π键和1个σ键,故A正确;
B.σ键为球对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.由价电子可知HBr 分子中的σ键是s-p σ键,Cl2分子中的σ键是p-p σ键,故C正确;
D.稀有气体是单原子分子,分子中不存在共价键,所以稀有气体中没有σ键,所以多原子构成的气体单质中一定存在σ键,故D错误;
故选D.
点评 本题考查共价键的形成及类型,注意σ键、π键的形成过程及判断的一般规律即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
8.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
7.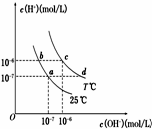 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Ba2+、K+、NO3- | |
| B. | b点对应的溶液中大量存在:Na+、K+、NH4+、Cl- | |
| C. | d点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | c点对应的溶液中大量存在:CO32-、Na+、Cu2+、SO42- |
14.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |
11.有7种物质:①乙烷②乙烯③乙炔④苯⑤甲苯⑥溴乙烷⑦聚丙烯,其中既不能使酸性KMnO4溶液褪色,也不能与溴水因发生化学反应而使溴水褪色的是( )
| A. | ①②③⑤ | B. | ①④⑥⑦ | C. | ②④⑥⑦ | D. | ②③④⑤ |
12.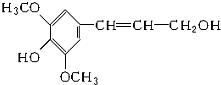 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、取代、加成 |
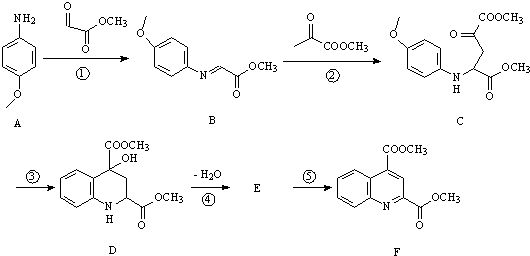

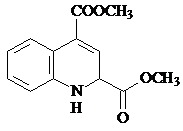 .
. 或
或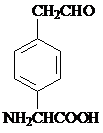 .
.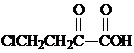 和苯、乙醇为原料,可合成
和苯、乙醇为原料,可合成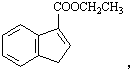 ,写出合成流程
,写出合成流程

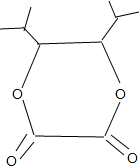 +2H2O;
+2H2O; ;
;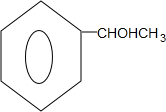 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.