题目内容
为了探究硝酸的性质,某研究小组同学进行了如下操作:
(1)从试剂柜里取一瓶浓硝酸,发现其保存在
(2)同学们欲用该浓硝酸(15mol/L)来配制一定体积3mol/L的稀硝酸,若发生如下列情况之一,所配制稀硝酸的浓度会如何变化?(填“偏高”、“偏低”或“不影响”)
①所用的容量瓶内有少量的蒸馏水:
②配制过程中忘记洗涤烧杯和玻璃棒:
③俯视容量瓶的刻度线进行定容:
(3)取两支试管,分别放入一小块铜片.向第一支试管中滴加浓硝酸,反应的化学方程式是
(4)该小组在探究的过程中,所用到的研究物质性质的基本方法有
(1)从试剂柜里取一瓶浓硝酸,发现其保存在
棕色
棕色
色的试剂瓶里,原因是(用化学方程式表示)4HNO3
4NO2↑+O2↑+2H2O
| ||
4HNO3
4NO2↑+O2↑+2H2O
.打开瓶盖,小心地扇闻浓硝酸的气味.
| ||
(2)同学们欲用该浓硝酸(15mol/L)来配制一定体积3mol/L的稀硝酸,若发生如下列情况之一,所配制稀硝酸的浓度会如何变化?(填“偏高”、“偏低”或“不影响”)
①所用的容量瓶内有少量的蒸馏水:
无影响
无影响
.②配制过程中忘记洗涤烧杯和玻璃棒:
偏低
偏低
.③俯视容量瓶的刻度线进行定容:
偏高
偏高
.(3)取两支试管,分别放入一小块铜片.向第一支试管中滴加浓硝酸,反应的化学方程式是
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
,向第二支试管中滴加稀硝酸,发生反应的化学方程式是3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
.两只试管内所产生气体,其相互间转化的方程式是3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
(写出一个即可).(4)该小组在探究的过程中,所用到的研究物质性质的基本方法有
观察法、实验法、比较法
观察法、实验法、比较法
(至少写出2种).分析:(1)浓硝酸见光易分解,所以要保存在棕色试剂瓶中;
(2)根据c=
分析判断误差;
(3)依据稀硝酸和浓硝酸都和铜发生反应写出化学方程式;根据二氧化氮可以与水反应生成硝酸和一氧化氮;
(4)该小组所用到的研究物质性质的基本方法有:观察法、实验法、比较法.
(2)根据c=
| n |
| V |
(3)依据稀硝酸和浓硝酸都和铜发生反应写出化学方程式;根据二氧化氮可以与水反应生成硝酸和一氧化氮;
(4)该小组所用到的研究物质性质的基本方法有:观察法、实验法、比较法.
解答:解:(1)浓硝酸见光易分解,方程式为:4HNO3
4NO2↑+O2↑+2H2O,
故答案为:棕色;4HNO3
4NO2↑+O2↑+2H2O;
(2)①所用的容量瓶内有少量的蒸馏水,对体积无影响,根据c=
分析可知,所配制稀硝酸的浓度不变,
故答案为:无影响;
②配制过程中忘记洗涤烧杯和玻璃棒,溶质的物质的量偏小,根据c=
分析可知,所配制稀硝酸的浓度偏低,
故答案为:偏低;
③俯视容量瓶的刻度线进行定容,溶液的体积偏小,根据c=
分析可知,所配制稀硝酸的浓度偏高,
故答案为:偏高;
(3)铜片与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;铜片与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;二氧化氮可以与水反应生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
3NO2+H2O═2HNO3+NO;
(4)该小组在探究的过程中,所用到的研究物质性质的基本方法有观察法、实验法、比较法,
故答案为:观察法、实验法、比较法.、
| ||
故答案为:棕色;4HNO3
| ||
(2)①所用的容量瓶内有少量的蒸馏水,对体积无影响,根据c=
| n |
| V |
故答案为:无影响;
②配制过程中忘记洗涤烧杯和玻璃棒,溶质的物质的量偏小,根据c=
| n |
| V |
故答案为:偏低;
③俯视容量瓶的刻度线进行定容,溶液的体积偏小,根据c=
| n |
| V |
故答案为:偏高;
(3)铜片与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;铜片与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;二氧化氮可以与水反应生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
3NO2+H2O═2HNO3+NO;
(4)该小组在探究的过程中,所用到的研究物质性质的基本方法有观察法、实验法、比较法,
故答案为:观察法、实验法、比较法.、
点评:本题主要考查了硝酸的性质,难度不大,注意稀硝酸与金属反应得到NO,浓硝酸与金属反应得到NO2.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
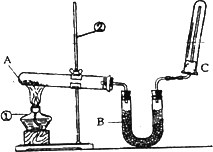
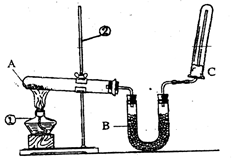
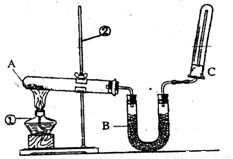
 ①还缺少的仪器有 ;
①还缺少的仪器有 ;