��Ŀ����
ijͬѧΪ��̽���Ȼ�淋����ʣ�����������ʵ�飬���㰴Ҫ��ش��������⡣
��1������100mL1mol/L��NH4Cl��Һ����ͬѧӦ��������ƽ����NH4Cl���������Ϊ g��
�������������ձ�����ͷ�ιܡ��������Ȳ���������
 �ٻ�ȱ�ٵ������� ��
�ٻ�ȱ�ٵ������� ��
��ʹ������ƿǰ������е�һ�������� ��
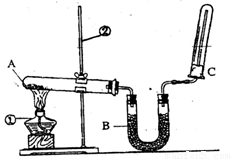
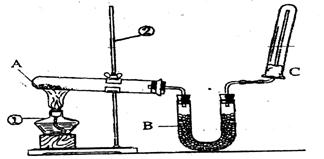
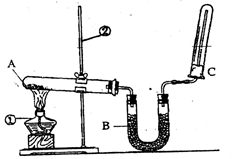
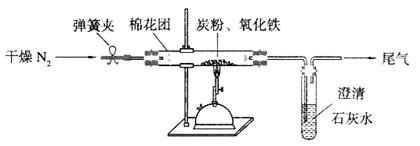
��2����ͬѧ������ͼ��ʾ��װ�������йذ���������ʵ�顣
��д��ʵ�����ư����Ļ�ѧ����ʽ�� ��
��д��B��ʢ�ŵ��Ǽ�ʯ���������� ��
�۰�����������ˮ���ڰ�ˮ�еμӷ�̪������ ��
�ܼ��鰱���ķ����� ��
��6�֣���ϡ�����з���������ͭƬ��
��1����Ӧ�Ļ�ѧ����ʽΪ ��
��2������Ӧֹͣ���ټ�������25%��ϡ���ᣬ��ʱͭƬ���������ݲ�������ԭ���� ���������ӷ���ʽ��ʾ��
��3������12.8gͭ��һ������Ũ���ᷴӦ��ͭ������ʱ������������5.6L����
״���£����������ĵ���������ʵ����� ��
�� ��8�֣�
��1��5.4g����100mL����ƿ �ڼ���Ƿ�©ˮ
��2���٢�Ca(OH)2 + NH4Cl ![]() CaCl2 + 2NH3�� + 2H2O
CaCl2 + 2NH3�� + 2H2O
������ˮ���� ����Һ����ɫ��Ϊ��ɫ
����ʪ��ĺ�ɫʯ����ֽ ��պ��Ũ����IJ��������������ɸ���)
��6�֣�ÿ��2�֣�Ks5u
��1��3Cu + 8HNO3��ϡ��= 3Cu(NO3)2 + 2NO�� + 4H2O
��2��3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO�� + 4H2O
��3��0.65mol
Ks5u

 ��У����ϵ�д�
��У����ϵ�д�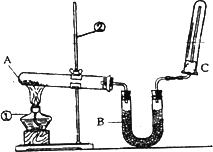

 ��ʵ���з����Ļ�ѧ����ʽΪ ��
��ʵ���з����Ļ�ѧ����ʽΪ �� CH3OH(g)
CH3OH(g)