题目内容
Ⅰ.某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题.
(1)配制100 mL 1 mol/L的NH4Cl溶液.该同学应用托盘天平称量NH4Cl固体的质量为________g.
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器.
①还缺少的仪器有________;
②使用容量瓶前必须进行的一步操作是________;
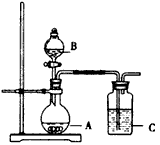
(2)该同学又用下图所示的装置做了有关氨气的性质实验.
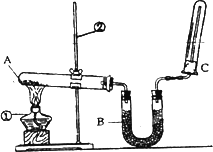
①写出实验室制氨气的化学方程式:________;
②写出B中盛放的是碱石灰其作用是________;
③氨气极易溶于水,在氨水中滴加酚酞现象是________;
④检验氨气的方法是________.
Ⅱ.在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为________;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是________.(用离子方程式表示)
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况下).则所消耗的硝酸的物质的量是________.
答案:

练习册系列答案
相关题目
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验: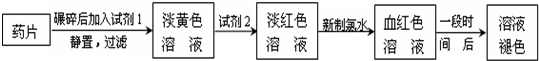
(1)试剂1是 .
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 .
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)

(1)试剂1是
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |