题目内容
10.下列叙述正确的是( )| A. | 在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等 | |
| B. | 等物质的量的N2和CO在标准状况下的体积均为22.4L | |
| C. | 同温同压下,等体积的物质所含分子数目一定相等 | |
| D. | 1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目相同 |
分析 A.根据N=nNA计算分析;
B.标准状况下,Vm=22.4L/mol;
C.同温同压下,等体积的气体所含有分子数相同;
D.盐酸中没有HCl分子,但是含有水分子.
解答 解:A.在任何条件下,等物质的量的乙烯(C2H4)和CO,由N=nNA可知所含的分子数目相等,故A正确;
B.标准状况下,Vm=22.4L/mol,由于气体的物质的量不知道,所以无法计算气体的体积,故B错误;
C.同温同压下,等体积的气体所含有分子数相同,不是气体无法计算分子数,故C错误;
D.盐酸中没有HCl分子,但是含有水分子,则1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目不相同,故D错误.
故选A.
点评 本题考查了阿伏伽德罗定律及其推论、物质的量的计算等,题目难度不大,注意把握阿伏伽德罗定律及其推论的内容.

练习册系列答案
相关题目
20.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液,甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为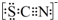 .
.
①同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成NO3-
④SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
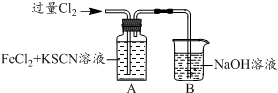 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液,甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
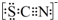 .
.①同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成NO3-
④SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
1.下列反应完毕后有沉淀的是( )
| A. | KOH 溶液与FeCl3 溶液加足量稀硝酸 | |
| B. | Ba(OH)2 溶液与KNO3溶液加足量H2SO4 | |
| C. | CuSO4溶液与NaOH 溶液加足量稀盐酸 | |
| D. | BaCl2 溶液与Na2CO3 溶液加足量稀醋酸 |
5.对于Na、Na2O、NaOH和Na2CO3四种物质,按一定标准划分,将有一种物质和其中三种物质不属于同一类.该物质是( )
| A. | Na | B. | Na2O | C. | NaOH | D. | Na2CO3 |
15.下列事实不能用勒夏特列原理解释的是( )
| A. | 打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫 | |
| B. | 镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀 | |
| C. | 加热后的纯碱水洗油污比冷碱水效果好 | |
| D. | FeCl3滴入沸水中,煮沸片刻得到红褐色胶体 |
19.下列参数比较及解释均正确的是( )
| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |