题目内容
2.实验室要用Na2CO3配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:①应该用托盘天平称取Na2CO35.3g.
②需要的仪器:托盘天平,烧杯,玻璃棒,500ml容量瓶,胶头滴管.
③若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.转移液体时部分溅出偏低;
B.定容时加水超过刻度线偏低;
C.最终定容时俯视观察液面偏高.
分析 ①根据m=CVM计算需要碳酸钠的质量;
②根据配制步骤选择使用仪器;
③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:①配制500mL 0.1mol•L-1 Na2CO3溶液,需要碳酸钠质量m=0.1mol/L×0.5L×106g/L=5.3g;
故答案为:5.3;
②配制500mL 0.5mol•L-1的Na2CO3溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,用到的仪器为:天平、药匙、烧杯、500mL容量瓶、玻璃棒、胶头滴管;
所以需要的仪器:托盘天平,烧杯,玻璃棒,500ml容量瓶,胶头滴管;
故答案为:托盘天平,烧杯,玻璃棒,500ml容量瓶,胶头滴管;
③A.转移液体时部分溅出,导致溶质部分损失,溶质的物质的量偏小,溶液浓度偏低;
B.定容时加水超过刻度线,导致溶液体积偏大,溶液浓度偏低;
C.最终定容时俯视观察液面,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏低,偏低,偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

练习册系列答案
相关题目
12.下列有关物质性质的应用正确的是( )
| A. | 铜的金属活动性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 铵盐受热易分解,实验室常加热硝酸铵与氢氧化钙的混合物制取氨气 | |
| C. | 氯化铁有氧化性,工业上用FeCl3溶液蚀刻铜箔制造电路板 | |
| D. | 氨水具有弱碱性,可与饱和氯化铁溶液反应制得氢氧化铁胶体 |
13.下列离子方程式中,书写不正确的是( )
| A. | 澄清的石灰水跟盐酸反应:H++OH-═H2O | |
| B. | 硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将溴水加入碘化钾溶液中:Br2+2I-═2Br-+I2 | |
| D. | 盐酸滴在石灰石上:CaCO3+2 H+═Ca2++CO2↑+H2O |
10.下列叙述正确的是( )
| A. | 在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等 | |
| B. | 等物质的量的N2和CO在标准状况下的体积均为22.4L | |
| C. | 同温同压下,等体积的物质所含分子数目一定相等 | |
| D. | 1molHCl中所含的分子数目和1L1mol/L盐酸中所含的分子数目相同 |
17.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol,假设1mol冰中有2mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
7. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
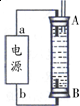
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
12.下列关于硫及其化合物的说法中正确的是( )
| A. | 自然界中不存在游离态的硫 | |
| B. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| C. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 | |
| D. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |