题目内容
已知:将SO2通入FeCl3溶液中,溶液颜色会变为浅绿色,其原理可表示为:
______Fe3++______SO2+______H2O═______Fe2++______SO42-+______H+
(1)请配平上述离子方程式;
(2)若参加反应的SO2在标准状况下的体积为1.12L,则该反应转移的电子的物质的量为______mol;
(3)已知向Fe2+溶液中滴加少量硝酸时,溶液由浅绿色变为黄色.则Fe3+、SO42-、HNO3的氧化性由强到弱的顺序为______.
______Fe3++______SO2+______H2O═______Fe2++______SO42-+______H+
(1)请配平上述离子方程式;
(2)若参加反应的SO2在标准状况下的体积为1.12L,则该反应转移的电子的物质的量为______mol;
(3)已知向Fe2+溶液中滴加少量硝酸时,溶液由浅绿色变为黄色.则Fe3+、SO42-、HNO3的氧化性由强到弱的顺序为______.
(1)Fe3+→Fe2+,化合价从+3→+2,降低1价,SO2→SO42-,化合价从+4→+6,升高2价,化合价升高和降低总数相等,
故铁元素前面系数为2,硫元素前面系数为1,则2Fe3++1SO2+H2O═2Fe2++1SO42-+H+,再根据氧原子守恒可知H2O前面系数为2,H+前系数为4,
故答案为:2;1;2;2;1;4;
(2)SO2的物质的量为
=0.05mol,根据SO2
SO42-计算转移电子数:0.05mol×2=0.1mol,
故答案为:0.1;
(3)浅绿色为亚铁离子颜色,黄色为三价铁离子颜色,溶液由浅绿色变为黄色,说明亚铁离子被氧化为铁离子,故氧化性硝酸强于三价铁离子,根据(1)可知,三价铁离子氧化性强于SO42-,故答案为:HNO3>Fe3+>SO42-.
故铁元素前面系数为2,硫元素前面系数为1,则2Fe3++1SO2+H2O═2Fe2++1SO42-+H+,再根据氧原子守恒可知H2O前面系数为2,H+前系数为4,
故答案为:2;1;2;2;1;4;
(2)SO2的物质的量为
| 1.12L |
| 22.4L/mol |
| 2e- |
故答案为:0.1;
(3)浅绿色为亚铁离子颜色,黄色为三价铁离子颜色,溶液由浅绿色变为黄色,说明亚铁离子被氧化为铁离子,故氧化性硝酸强于三价铁离子,根据(1)可知,三价铁离子氧化性强于SO42-,故答案为:HNO3>Fe3+>SO42-.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
 O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为( )
O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为( ) ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(OH)2
Cu(OH)2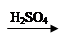 CuSO4
CuSO4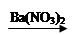 Cu(NO3)2
Cu(NO3)2