题目内容
过量铁粉与稀硝酸可以发生反应.
(1)配平该反应的化学方程式
______Fe+______HNO3(稀)=______Fe(NO3)2+______NO↑+______H2O
(2)该反应中稀硝酸的作用是______;
(3)标准状况下,当生成2.24LNO气体时,有______gFe参加反应,转移电子的物质的量为______,有______mol氧化剂被还原.
(1)配平该反应的化学方程式
______Fe+______HNO3(稀)=______Fe(NO3)2+______NO↑+______H2O
(2)该反应中稀硝酸的作用是______;
(3)标准状况下,当生成2.24LNO气体时,有______gFe参加反应,转移电子的物质的量为______,有______mol氧化剂被还原.
(1)该反应中铁元素的化合价变化为0→+2,所以一个铁原子失去2个电子,氮元素的化合价变化为+5→+2,所以一个参加氧化还原反应的硝酸根离子得到3个电子,所以得失的最小公倍数是6,所以铁的计量数是3,NO的计量数是2,其它元素根据原子守恒进行配平,所以该方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
故答案为:3、8、3、2、4;
(2)该反应中氮元素的化合价变化为硝酸中的+5→NO中的+2,N元素的化合价降低,则HNO3为氧化剂,氮元素从硝酸中的+5→Fe(NO3)2中的+2,显示了硝酸的酸性,
故答案为:酸性、氧化性;
(3)标准状况下,当生成2.24L NO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,氮元素的化合价变化为+5→+2,由N原子守恒可知,0.1mol氧化剂被还原,参加反应的Fe为0.1mol×
×56g/mol=8.4g,
故答案为:8.4;0.3mol;0.1.
故答案为:3、8、3、2、4;
(2)该反应中氮元素的化合价变化为硝酸中的+5→NO中的+2,N元素的化合价降低,则HNO3为氧化剂,氮元素从硝酸中的+5→Fe(NO3)2中的+2,显示了硝酸的酸性,
故答案为:酸性、氧化性;
(3)标准状况下,当生成2.24L NO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,氮元素的化合价变化为+5→+2,由N原子守恒可知,0.1mol氧化剂被还原,参加反应的Fe为0.1mol×
| 3 |
| 2 |
故答案为:8.4;0.3mol;0.1.

练习册系列答案
相关题目
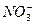 +( )H++( )e-="===( " )NO+( )H2O,该式的配平系数是( )
+( )H++( )e-="===( " )NO+( )H2O,该式的配平系数是( ) >Fe3+>I2,以下实验的结论或实验的预测合理的是
>Fe3+>I2,以下实验的结论或实验的预测合理的是