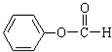
题目内容
10.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4L SO3含有的原子数为4NA | |
| B. | 78 g过氧化钠中含有的离子数为4NA | |
| C. | 过氧化钠与CO2反应生成32g O2,则反应转移的电子数为2NA | |
| D. | 密闭容器中,标准状况下22.4L SO2和11.2LO2 在加热、有催化剂的条件下充分反应,容器中的分子总数为NA |
分析 A、标准状况下,22.4L SO3是固体,不能用气体摩尔体积公式计算;
B、78 g过氧化钠的物质的量为78g78g/mol78g78g/mol=1mol,含有的离子数目为1mol×3NAmol-1=3NA;
C、根据转移的电子:O2~2e-,生成32g O2,生成1molO2转移的电子数为2NA;
D、SO2和O2 的反应是可逆反应,容器中的分子总数大于NA.
解答 解:A、标准状况下,22.4L SO3是固体,不能用气体摩尔体积公式计算,故A错误;
B、78 g过氧化钠的物质的量为78g78g/mol=1mol,含有的离子数目为1mol×3NAmol-1=3NA,故B错误;
C、根据转移的电子:O2~2e-,生成32g O2,生成1molO2转移的电子数为2NA,故C正确;
D、SO2和O2 的反应是可逆反应,容器中的分子总数大于NA,故D错误.
故选C.
点评 考查常用化学计量的有关计算与理解,难度不大,注意气体摩尔体积的使用条件与对象.

练习册系列答案
相关题目
1.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 mol Fe溶解于一定量的HN03溶液中,电子转移数介于2NA和3NA间 | |
| B. | L mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个Fe(OH)3胶粒 | |
| C. | 0.01 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| D. | 10 mL 5mol/L (NH4)2S04溶液中含有NH4+数目为0.1NA个 |
18.H2O2可作脱氯剂,除去氯气的不良影响,方程式如下:H2O2+Cl2=2HCl+O2.以下推断正确的是( )
| A. | 该反应为置换反应 | B. | 每生成1mol O2转移4mol e- | ||
| C. | H2O2被还原 | D. | 反应后溶液pH值升高 |
5.下列离子方程式正确的是( )
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
4.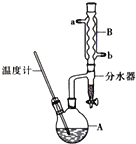 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
据如下:
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下据如下:
| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. (2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.

 .
.