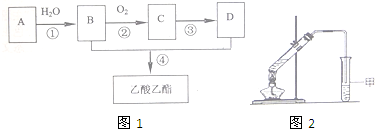
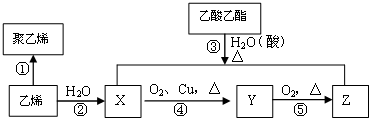
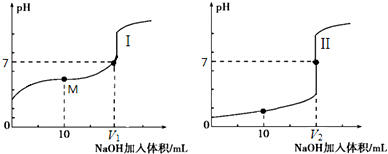
题目内容
16.(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.①NaCl、KCl、NaClO、BaCl2NaClO ②浊液、溶液、胶体、水水
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,所需浓H2SO4的体积为13.6ml(小数点后保留一位有效数字),如果实验室有10ml、20ml、50ml量筒,应选用20ml量筒;实验中还需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、500mL容量瓶,若实验中出现下列现象,造成所配溶液浓度偏高的有AC(填序号)
A.浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容
B.定容时仰视刻度线
C.量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为 10.21g,试计算混合溶液中Na2CO3的物质的量浓度是0.4mol/L.
分析 (1)①NaClO为含氧酸盐,其余为无氧酸盐;
②水为纯净物,其余为混合物;
(2)浓H2SO4的物质的量浓度c=$\frac{1000ρw}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器,根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(3)根据Na2CO3+2HCl═2NaCl+H2O+CO2↑来计算原混合溶液中Na2CO3的物质的量浓度.
解答 解:(1)①NaClO为含氧酸盐,其余为无氧酸盐,故选:NaClO;
②水为纯净物,其余为混合物,故选:水;
(2)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,用20ml的量筒最好,配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、20mL量筒、500mL容量瓶.
A、浓硫酸溶解后未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,浓度偏高,故A正确;
B、定容时仰视刻度线,溶液体积增大,浓度偏低,故B错误;
C、量筒是已经测量好的量具,量取溶液体积后不能用水洗涤,量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯 导致溶质量增大,配制浓度偏高,故C正确;
故答案为:13.6;20;500mL容量瓶;AC;
(3)标况下CO2的物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,
由Na2CO3+2HCl═2NaCl+H2O+CO2↑可知,酸足量时,
n(Na2CO3)=n(CO2)=0.04mol,
则c(Na2CO3)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:0.4.
点评 本题考查了一定物质的量浓度溶液的配制,化学方程式的计算,难度中等,根据c=$\frac{n}{V}$理解溶液配制原理与误差分析,注意浓硫酸的稀释操作.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 常温常压下,32gO2和32gO3所含氧原子数都是NA | |
| C. | 1molFe与足量盐酸反应,转移电子数为3NA | |
| D. | 标准状况下36g H2O中原子的数目为6NA |
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
| A. | C | B. | K | C. | S | D. | Ca |
| A. | 提纯胶体可采用渗析的方法 | |
| B. | 用丁达尔效应可以区别溶液和胶体 | |
| C. | 往氯化铁溶液中滴加少量氢氧化钠溶液可制得氢氧化铁胶体 | |
| D. | 加热可使胶体发生聚沉 |
 CH3COOC2H5+H2O
CH3COOC2H5+H2O